
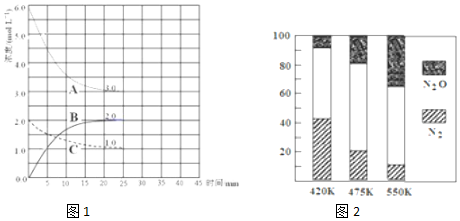
分析 (1)①根据图象可知,反应进行到25min时曲线A减少了6mol/L-3mol/L=3mol/L,C减少了2.0mol/L-1.0mol/L=1.0mol/L,因此根据方程式可知表示N2浓度变化的曲线是C,H2浓度变化的曲线为A,B为氨气的浓度变化曲线;
②由图可知,平衡时△c(A)=3mol/L、△c(B)=2mol/L、△c(C)=1mol/L,故△c(A):△c(B):△c(C)=3:2:1,故A代表氢气、B代表氨气、C代表氮气,根据v=$\frac{△c}{△t}$计算v(H2);由可知平衡时各组分的平衡浓度,c(H2)=3mol/L、c(N2)=1mol/L、c(NH3)=2mol/L,代入平衡常数表达式计算;
③提高N2的转化率,应使平衡正向移动,可增大压强、增大氢气的浓度等;
(2)a.正反应是体积减少的可逆反应,因此在恒温恒压下气体体积不再变化时已平衡;
b.在反应过程中质量始终不变,但容器容积是变化的,所以密度是变化的,因此气体密度不再变化说明反应达到平衡;
c.平衡后,往装置中通入一定量Ar,压强不变,容器容积增加,浓度降低,平衡向逆反应方向移动;
d.平衡后,压缩容器,压强增大,平衡向正反应方向进行;
(3)根据图2中随着温度升高,氮气、N2O的含量变化进行分析;根据温度对化学平衡影响及两个可逆反应的反应热情况进行分析.
解答 解:(1)①根据图象可知,反应进行到25min时曲线A减少了6mol/L-3mol/L=3mol/L,C减少了2.0mol/L-1.0mol/L=1.0mol/L,因此根据方程式可知表示N2浓度变化的曲线是C,A浓度变化的曲线为H2,B为氨气的浓度变化曲线,
故答案为:C;
②由图可知,平衡时△c(A)=3mol/L、△c(B)=2mol/L、△c(C)=1mol/L,故△c(A):△c(B):△c(C)=3:2:1,故A代表氢气、B代表氨气、C代表氮气,故v(H2)=$\frac{3mol/L}{25min}$=0.12 mol•L-1•min-1,由可知平衡时各组分的平衡浓度,c(H2)=3mol/L、c(N2)=1mol/L、c(NH3)=2mol/L,故平衡常数k=$\frac{{2}^{2}}{1×{3}^{3}}$=0.148,
故答案为:0.12mol/(L•min); 0.148;
③a.反应为放热反应,升高温度平衡逆向进行,氮气转化率减小,故a错误;
b.加入催化剂改变反应速率不改变化学平衡,氮气转化率不变,故b错误;
c.通入1molHe气总压增大,分压不变平衡不变,氮气转化率不变,故c错误;
d.通入1molHCl和氨气反应,促进平衡正向进行,氮气转化率增大,故d正确;
故答案为:d;
(2)a.正反应是气体物质的量减小的反应,恒温恒压下,随反应进行体积减少,因此在恒温恒压下气体体积不再变化时已平衡,故a正确;
b.在反应过程中质量始终不变,但容器容积是变化的,所以密度是变化的,因此气体密度不再变化说明反应达到平衡,故b正确;
c.平衡后,压缩容器,压强增大,平衡向正反应方向进行,因此生成更多NH3,故c正确;
d.平衡后,往装置中通入一定量Ar,压强不变,容器容积增加,浓度降低,平衡向逆反应方向移动,故d错误,
故选:abc,
故答案为:abc;
(3)根据图象可知,在400K~600K时,平衡混合气中N2含量随温度的升高逐渐降低;主反应为放热反应,升高温度,平衡向着逆向移动,氮气的含量减小,
故答案为:随温度升高,N2的含量降低;主反应为放热反应,升温使主反应的平衡左移或者副反应为吸热反应,升温使副反应的平衡右移,降低了NH3和NO浓度,使主反应的平衡左移.
点评 本题考查盖斯定律、化学平衡图象、化学平衡移动的影响因素、原电池原理的应用和电极反应书写,题目难度中等,注意对基础知识的理解掌握.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | ①③④ | B. | ②④ | C. | 只有④ | D. | 全部错误 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “水乳交融,火上浇油”前者包含物理变化,而后者包含化学变化 | |
| B. | “曾青得铁化为铜”发生了置换反应 | |
| C. | “春蚕到死丝方尽”中的“丝”的和“慈母手中线,游子身上衣”中的棉“线”主要成分都是纤维素 | |
| D. | “卤水点豆腐,一物降一物”的前半句话与胶体知识有关 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 纯碱和烧碱都属于碱 | |
| B. | 凡是能电离出H+的化合物都叫做酸 | |
| C. | 铝片在空气中能剧烈燃烧并放出大量的热 | |
| D. | NH3的水溶液可以导电,但NH3属于非电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电池工作时锌为负极 | |
| B. | 电池正极的电极反应式为:2MnO2+2H2O+2e-═2MnOOH+2OH- | |
| C. | 电池工作时,电解液的OH-移向正极 | |
| D. | 外电路中每通过0.2mol电子,锌的质量理论上减少6.5g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
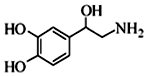
| A. | 每个去甲肾上腺素分子中含有3个酚羟基 | |
| B. | 每个去甲肾上腺素分子中含有8种氢原子 | |
| C. | 1mol去甲肾上腺素最多能与2molBr2发生取代反应 | |
| D. | 去甲肾上腺素既能与盐酸反应,又能与氢氧化钠溶液反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com