
 在含有弱电解质的溶液中,往往有多个化学平衡共存.
在含有弱电解质的溶液中,往往有多个化学平衡共存.分析 (1)常温下,将0.2mol/L的某一元酸HA溶液和0.1mol/L NaOH溶液等体积混合后,得到溶液溶质为NaA和HA,溶液pH大于7,说明A-离子水解程度大于HA电离程度;
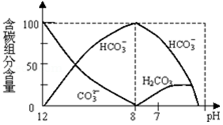
(2)常温下在20mL0.1mol/L Na2CO3溶液中逐滴加入0.1mol/L HCl溶液40mL,先反应生成碳酸氢钠,再与盐酸反应生成二氧化碳、水,
①根据图象判断H2CO3、HCO3-、CO32-能否大量共存,
②当pH=7时,溶液中溶质为碳酸氢钠、氯化钠,根据电荷守恒解答;
③水解常数Kh=$\frac{c(HC{{O}_{3}}^{-})c(O{H}^{-})}{c(C{{O}_{3}}^{2-})}$=2×10-4,当溶液中c(HCO3-):c(CO32-)=2:1时,c(OH-)=10-4mol/L,根据Kw计算出c(H+),再计算出溶液的pH.
解答 解:(1)0.2mol/L的某一元酸HA溶液和0.1mol/L NaOH溶液等体积混合后,反应后得到等量的HA、NaA,溶液pH大于7,则盐类水解大于酸的电离,
A. 水解生成HA,则c(HA)>c(A-),故A错误;
B.因等体积混合,则反应后c(HA)一定小于0.1mol/L,故B错误;
C.反应后得到等量的HA、NaA,则2c(Na+)=c(HA)+c(A-),故C错误;
D.由电荷守恒可知,c(Na+)+c(H+)=c(OH-)+c(A-),又2c(Na+)=c(HA)+c(A-),则c(OH-)=c(H+)+$\frac{1}{2}$[c(HA)-c(A-)],故D正确;
故答案为:D;
(2)常温下在20mL0.1mol/L Na2CO3溶液中逐滴加入0.1mol/L HCl溶液40mL,先反应生成碳酸氢钠,再与盐酸反应生成二氧化碳、水,
①由反应及图象可知,在同一溶液中,H2CO3、HCO3-、CO32-不能大量共存,故答案为:不能;
②当pH=7时,溶液中溶质为碳酸氢钠、氯化钠,溶液中各种离子其物质的量浓度之间的等量关系是电荷守恒:c(Na+)+c(H+)=c(Cl-)+c(HCO3-)+c(OH-)+2c(CO32-);
故答案为:c(Na+)+c(H+)=c(Cl-)+c(HCO3-)+c(OH-)+2c(CO32-);
③水解常数Kh=$\frac{c(HC{{O}_{3}}^{-})c(O{H}^{-})}{c(C{{O}_{3}}^{2-})}$=2×10-4,当溶液中c(HCO3-):c(CO32-)=2:1时,c(OH-)=10-4mol/L,由Kw可知,c(H+)=10-10mol/L,所以pH=10,
故答案为:10.
点评 本题考查较综合,涉及溶液中离子浓度大小分析,化学平衡常数的计算及溶液中酸碱之间的反应,题目难度中等,综合考查学生分析问题、解决问题的能力,注重能力的考查.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(CH3COOH):①>② | B. | c(CH3COO-):①>② | ||
| C. | c(CH3COOH)+c(CH3COO-):①=② | D. | c(CH3COO-)+c(OH-):①<② |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
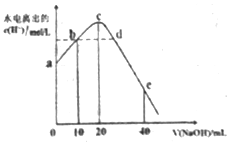 常温下,向20ml0.01mol•L-1CH3COOH溶液中逐滴加入0.01mol•L-1的NaOH溶液,溶液中水所电离出的c(H+)随加入NaOH溶液的体积变化示意图如图所示,下列说法不正确的是( )
常温下,向20ml0.01mol•L-1CH3COOH溶液中逐滴加入0.01mol•L-1的NaOH溶液,溶液中水所电离出的c(H+)随加入NaOH溶液的体积变化示意图如图所示,下列说法不正确的是( )| A. | 从a到c,醋酸的电离始终受到促进 | |
| B. | 从b→c的过程中,既存在着pH=7的点,也存在着溶液中水所电离出的c(H+)=10-7的点 | |
| C. | b点:2c(Na+)=c(CH3COO-)+c(CH3COOH) | |
| D. | a、d对应的纵坐标数值分别是:>10-12、>10-7 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,1mol H2O的体积约为22.4L | |
| B. | 106g Na2CO3含有的Na+离子数为2 NA | |
| C. | 常温常压下,1 NA 个CO2分子占有的体积为22.4L | |
| D. | 1mol任何粒子的粒子数叫做阿伏加德罗常数,通常用6.02×1023表示 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某溶液$\stackrel{+石蕊}{→}$溶液呈红色:原溶液是酸溶液 | |
| B. | 某溶液$\stackrel{+盐酸酸化}{→}$无明显现象$\stackrel{+BaCl_{2}溶液}{→}$有白色沉淀:原溶液中含SO42- | |
| C. | 某溶液$\stackrel{+酚酞}{→}$溶液呈红色:原溶液是碱溶液 | |
| D. | 某溶液$\stackrel{+稀硫酸}{→}$生成无色无味气体,说明原溶液中有CO32- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com