
【题目】在200mL含Mg2+、Al3+、NH4+、H+、Cl-等离子的溶液中,逐滴加入5molL-1NaOH溶液,所加NaOH溶液的体积(mL)与产生沉淀的物质的量(mol)关系如图所示。下列叙述不正确的是( )
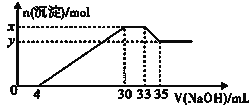
A.x-y=0.01molB.原溶液中c(Cl-)=0.75mol/L
C.原溶液的c(H+)=0.1mol/LD.原溶液中n(Mg2+):n(Al3+)=5:1
【答案】B
【解析】
向溶液中滴加NaOH溶液,并结合图象可知,0~4mL时发生酸碱中和,4mL~30mL发生Mg2+、Al3+结合OH-生成沉淀的反应,30mL~33mL发生NH4+与OH-的反应,33mL~35mL发生氢氧化铝的溶解反应,然后利用离子反应方程式来计算解答。
A.由图及离子反应可知x-y的值即为Al(OH)3的物质的量,设Al(OH)3的物质的量为n,Al(OH)3+OH-=AlO2-+2H2O,n[Al(OH)3]=n(OH-)=5mol/L×(35-33)mL×0.001L/mL=0.01mol,即x-y=0.01mol,A正确;
B.由图可知,加入33mLNaOH溶液时Cl-离子以NaCl存在,根据元素守恒可知此时溶液中n(Cl-)=n(Na+)=n(NaOH)=5mol/L×0.033L=0.165mol,则原溶液中Cl-的物质的量浓度c(Cl-)=0.165mol÷0.2L=0.0825mol/L,B错误;
C.由图0~4mL时发生H++OH-=H2O,则H+的物质的量n(H+)=4mL×0.001L/mL×5mol/L=0.02mol,所以H+的物质的量浓度c(H+)=0.02mol÷0.2L=0.1mol/L,C正确;
D.由4mL~30mL发生Mg2+、Al3+结合OH-生成沉淀的反应,则Al3++3OH-=Al(OH)3↓,n(Al3+)=n[Al(OH)3]= 0.01mol,则形成Al(OH)3沉淀消耗OH-的物质的量为0.03mol,Mg2+、Al3+结合OH-生成沉淀共消耗OH-的物质的量为5mol/L×(30-4)mL×0.001L/mL=0.13mol,则Mg2+形成沉淀消耗的OH-离子的物质的量为0.13mol-0.03mol=0.1mol,所以根据Mg2++2OH-=Mg(OH)2↓可知Mg2+的物质的量n(Mg2+)=0.1mol÷2=0.05mol,故原溶液中n(Mg2+):n(Al3+)=0.05:0.01=5:1,D正确;
故合理选项是B。


 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案科目:高中化学 来源: 题型:
【题目】臭氧(O3)主要分布在大气层的平流层中,能够吸收紫外线,被称为地球的保护伞。回答下列问题:
(1)NOx对臭氧层的破坏作用极大,已知:①NO+O3=NO2+O2 K1;NO2+O2=NO+O3; K2;③O2+O=O3 K3,反应2O3=3O2的平衡常数K=_______ (用K1、K2、K3表示),写出一种保护臭氧层的措施:__________。
(2)用臭氧氧化烟气中的SO2的主要反应为SO2(g)+O3(g)=SO3(g)+O2(g) △H,已知①2SO2(g)+O2(g)=2SO3(g) △H1=-198kJ/mol,②2O3(g)=3O2(g) △H2=+284.2kJ/mol
①上述反应中△H= ____kJmol-1。
②一定温度下,向2L固定容积的密闭容器中加入2molO3和2molSO2发生上述反应,5min后达到平衡,测得容器中含有0.4molL-1SO3,此时SO2的转化率为_______,欲提高O3的利用率可采取的措施有_______(填字母)。
a.适当增大压强 b.升高温度 c.使用优质催化剂 d.及时分离出SO3
(3)工业上用CaSO3悬浊液吸收上述转化生成的SO3可制备石膏。已知:298K时Ksp(CaSO4)=9.0×10-6,Ksp(CaSO3)=1.5×10-7,向1LCaSO3悬浊液中加入Na2SO4,若有0.1molCaSO3参与反应,则需加入_______molNa2SO4。
 ,
,
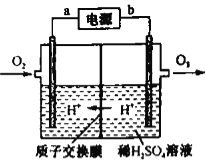
(4)工业上可采用惰性电极电极电解稀硫酸的方法制备O3,反应装置如上图所示,电源的a极为_____极,通入O2的电极反应式为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种双电子介体电化学生物传感器,用于检测水体急性生物毒性,其工作原理如图。下列说法正确的是( )
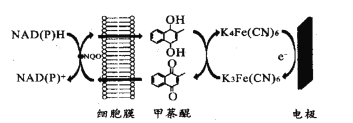
A.图中所示电极为阳极,其电极反应式为K4Fe(CN6)-e-=K3Fe(CN)6
B.甲荼醌在阴极发生氧化反应
C.工作时K+向图中所示电极移动
D.NAD(P)H转化为NAD(P)+的过程失去电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E五种物质的焰色反应都呈黄色,A、B与水反应都有气体放出,A与水反应放出的气体具有还原性,B与水反应放出的气体具有氧化性,同时都生成C的溶液,C与适量的CO2反应生成D,D溶液与过量的CO2反应生成E,E加热能生成D。
(1)写出下列物质的化学式:B____________,E_____________。
(2)写出A→C的化学方程式,并标出电子转移的方向和数目:_______________
(3)写出C→D的离子方程式:________________________________。
(4)写出E→D的化学方程式:________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烯、环氧乙院是重要的化工原料,用途广泛。回答下列问题:
已知:I.2CH2=CH2(g)+O2(g)![]() 2
2![]() (g) △H1=-206.6kJmo1-1
(g) △H1=-206.6kJmo1-1
II.CH2=CH2(g)+3O2(g)=2CO2(g)+2H2O(1) △H2
III.2![]() (g)+5O2(g)=4CO2(g)+4H2O(1) △H3
(g)+5O2(g)=4CO2(g)+4H2O(1) △H3
(1)反应III:△S(填“>”“<”或“=”)___0。
(2)热值是表示单位质量的燃料完全燃烧时所放出的热量,是燃料质量的一种重要指标。已知乙烯的热值为50.4kJg-1,则△H3=___kJmol-1
(3)实验测得2CH2=CH2(g)+O2(g)![]() 2
2![]() (g)中,v逆=k逆c2(
(g)中,v逆=k逆c2(![]() ),v正=k正c2(CH2=CH2)c(O2)(k正、k逆为速率常数,只与温度有关)。
),v正=k正c2(CH2=CH2)c(O2)(k正、k逆为速率常数,只与温度有关)。
①反应达到平衡后,仅降低温度,下列说法正确的是(________)
A.k正、k逆均增大,且k正增大的倍数更多
B.k正、k逆匀减小,且k正减小的倍数更少
C.k正增大、k逆减小,平衡正向移动
D.k正、k逆均减小,且k逆减小的倍数更少
②若在1L的密闭容器中充入1molCH2=CH2(g)和1molO2(g),在一定温度下只发生反应I,经过10min反应达到平衡,体系的压强变为原来的0.875倍,则0~10min内v(O2)=___,![]() =___。
=___。
(4)现代制备乙烯常用乙烷氧化裂解法:
C2H6(g)+![]() O2(g)=C2H4(g)+H2O(g) △H2=-110kJmol-1,反应中还存在CH4、CO、CO2等副产物(副反应均为放热反应),图1为温度对乙烷氧化裂解反应性能的影响。
O2(g)=C2H4(g)+H2O(g) △H2=-110kJmol-1,反应中还存在CH4、CO、CO2等副产物(副反应均为放热反应),图1为温度对乙烷氧化裂解反应性能的影响。
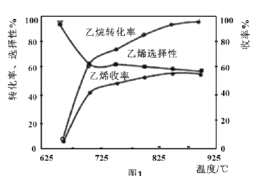
①乙烷的转化率随温度的升高而升高的原因是___;反应的最佳温度为___(填序号)。
A.650℃ B.700℃ C.850℃ D.900℃
[乙烯选择性=![]() ;乙烯收率=乙烷转化率×乙烯选择性]
;乙烯收率=乙烷转化率×乙烯选择性]
②工业上,保持体系总压恒定为l00kPa的条件下进行该反应,通常在乙烷和氧气的混合气体中掺混惰性气体(惰性气体的体积分数为70%),掺混惰性气体的目的是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在如图中表示的是有关物质(均由短周期元素形成)之间的转化关系,其中A为常见的金属单质,B为非金属单质(一般是黑色粉末),C是常见的无色无味液体,D是淡黄色的固体化合物。(反应条件图中已省略)。
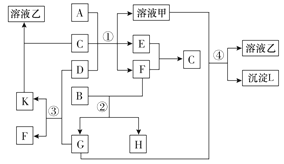
(1)A、C代表的物质分别为______、______(填化学式);
(2)反应①中的C、D均过量,该反应的化学方程式是 _____________;
(3)反应②中,若B与F物质的量之比为4:3,G、H物质的量之比为______;
(4)反应④的离子方程式为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知Ba(AlO2)2可溶于水,下图表示的是向Al2(SO4)3溶液中逐滴加入Ba(OH)2溶液时,生成沉淀的物质的量y与加入Ba(OH)2的物质的量x的关系。下列有关叙述正确的是( )
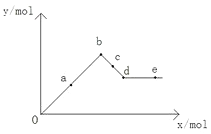
A.a-b时沉淀的物质的量:Al(OH)3比BaSO4多
B.c-d时溶液中离子的物质的量:Ba2+比AlO2-多
C.a-d时沉淀的物质的量:BaSO4可能小于Al(OH)3
D.d-e时溶液中离子的物质的量:Ba2+可能等于OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下的恒容容器中,.当下列物理量不再发生变化时,不能表明反应:A(s)+3B(g)![]() 2C(g)+D(g)已达平衡状态的是( )
2C(g)+D(g)已达平衡状态的是( )
①气体的平均相对分子质量不再变化;②单位时间内生成amolA,同时消耗2amolC;③容器中的压强不再变化;④混合气体的密度不再变化;⑤B的浓度不再变化;⑥n(A):n(B):n(C):n(D)=1:3:2:2
A.②③⑤B.①③④⑥C.②④⑤D.②③⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学采用如图装置进行实验,证明了铜与稀硝酸反应生成了NO。实验时,先向注射器内加入一定量的稀硝酸,排净注射器内的空气,迅速将带有铜丝的橡皮帽盖上,一段时间后,注射器内有无色气体产生。
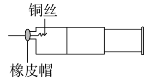
(1)铜与稀硝酸反应的化学方程式为__。
(2)NO是大气污染物之一。目前有一种治理方法是在400℃左右、有催化剂存在的情况下,用氨气把NO还原为氮气和水。该反应的化学方程式为4NH3+6NO![]() 5N2+6H2O,每有10molN2生成,氧化产物与还原产物的物质的量之比为__。
5N2+6H2O,每有10molN2生成,氧化产物与还原产物的物质的量之比为__。
(3)N2O4为氧化剂,可以与火箭燃料偏二甲肼(C2H8N2)反应,放出巨大能量,把火箭送入太空,同时产生两种无毒气体,反应的化学方程式为__。
(4)①写出实验室由NH4Cl和Ca(OH)2加热制取氨气的化学方程式__。
②进行喷泉实验,若在水中加入酚酞,得到红色喷泉。该实验体现了氨气的两个重要性质分别是__、__。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com