
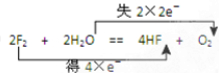
 ,故答案为:
,故答案为: .
.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| A、33.6L氯气与27g铝充分反应,转移的电子数一定为3NA |
| B、用0.2mol Cl2溶解于10L的水中,可生成0.2NA个HClO |
| C、由CO2和O2组成的混合物中共有NA个分子,其中的氧原子数为2NA |
| D、0.012kg 13C中,含碳原子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
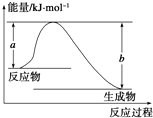 断开1mol AB(g)分子中的化学键使其分别生成气态A原子和气态B原子所吸收的能量称为A-B键的键能.下表列出了一些化学键的键能E:
断开1mol AB(g)分子中的化学键使其分别生成气态A原子和气态B原子所吸收的能量称为A-B键的键能.下表列出了一些化学键的键能E:| 化学键 | H-H | Cl-Cl | O═O | C-Cl | C-H | O-H | H-Cl |
| E/kJ?mol-1 | 436 | 247 | x | 330 | 413 | 463 | 431 |
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 S2Cl2常用于橡胶硫化,有机物氯化的试剂,某研究性学习小组拟用实验室常用试剂和仪器合成S2Cl2.
S2Cl2常用于橡胶硫化,有机物氯化的试剂,某研究性学习小组拟用实验室常用试剂和仪器合成S2Cl2.查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:

| 温度 | 平衡浓度/(mol L-1) | |
| c(NH3) | c(CO2) | |
| T1 | 0.1 | |
| T2 | 0.1 | |
| 成分 | 含量/(mg L-1) | 成分 | 含量/(mg L-1) |
| Cl- | 18980 | Ca2+ | 400 |
| Na+ | 10560 | HCO3- | 142 |
| SO42- | 2560 | Br- | 64 |
| Mg2+ | 1272 |
 电渗析法淡化海水示意图如图所示,其中阴(阳)离子交换膜仅允许阴(阳)离子通过.
电渗析法淡化海水示意图如图所示,其中阴(阳)离子交换膜仅允许阴(阳)离子通过.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na2S2O3溶液中加入稀盐酸:2S2O32-+2H+=SO42-+3S↓+H2O |
| B、磁性氧化铁溶于稀硝酸:3Fe3O4+28H++NO3-═9Fe3++NO↑+14H2O |
| C、100mL 0.1mol/L FeI2溶液与标况下0.224L Cl2:2Fe2++Cl2=2Fe3++2Cl- |
| D、向明矾溶液中滴加Ba(OH)2溶液,恰好使SO42-沉淀完全:2Al3++3SO42-+3Ba2++6OH -=2Al(OH)3↓+3BaSO4↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.1 mol/L |
| B、0.2 mol/L |
| C、0.3 mol/L |
| D、0.4 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2mol Na被完全氧化生成1mol Na2O2,得到2NA个电子 |
| B、25℃时pH=13的NaOH液中含有OH一的数目为0.1NA |
| C、标准状况下,6.72L NO2与水充分反应转移的电子数目为0.1NA |
| D、等物质的量的HCN与NaCN混合后溶液显碱件.则溶液中c(CN-)<c(HCN) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com