
| A. | 在受热条件下,HD能还原氧化铜 | |
| B. | HD能在氯气中燃烧生成HCl和DCl气体 | |
| C. | 是一种非金属单质 | |
| D. | 是一种化合物 |
分析 A.HD为氢气单质具有还原性;
B.HD为氢气单质在氯气中 燃烧生成HCl和DCl;
C.HD为氢气单质属于非金属单质;
D.不同元素组成的纯净物为化合物,HD为单质.
解答 解:A.HD为氢气单质具有还原性,可以还原氧化铜生成铜和水,故A正确;
B.氢气在氯气中 燃烧生成氯化氢气体,HD为氢气单质在氯气中 燃烧生成HCl和DCl,故B正确;
C.HD为氢气,是一种元素组成的纯净物为单质,属于非金属单质,故C正确;
D.不同元素组成的纯净物为化合物,HD为一种元素组成的纯净物为单质,故D错误;
故选D.
点评 本题考查了物质组成、物质分类、物质性质的理解应用,主要是同位素概念的实质分析,掌握基础是解题关键,题目难度不大.


科目:高中化学 来源: 题型:选择题
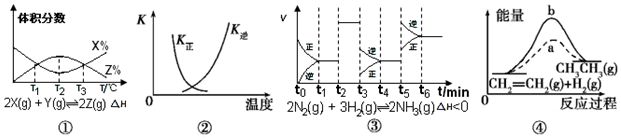
| A. | 由图①知,反应在T1、T3处达到平衡,且该反应的△H<0 | |
| B. | 图②中曲线表示反应2SO2(g)+O2(g)?2SO3(g),△H<0正、逆反应的平衡常数K随温度的变化 | |
| C. | 由图③知,反应在t6时,NH3体积分数最大,t3时采取降低反应温度的措施 | |
| D. | 图④中a、b曲线分别表示反应CH2=CH2(g)+H2(g)→CH3CH3(g)△H<0使用和未使用催化剂时,反应过程中的能量变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe+CuSO4═FeSO4+Cu | B. | 3CO+Fe2O3 $\frac{\underline{\;高温\;}}{\;}$ 2Fe+3CO2 | ||
| C. | AgNO3+NaCl═AgCl↓+NaNO3 | D. | 2KMnO4 $\frac{\underline{\;\;△\;\;}}{\;}$ K2MnO4+MnO2+O2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2SO4与K2CO3;HNO3与Na2CO3 | B. | CH3COOH与KOH;HCl与NaOH | ||
| C. | BaCl2与Na2SO4;Ba(OH)2与(NH4)2SO4 | D. | HCl与Na2CO3;HCl与NaHCO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | V(SO2)=4mol•L-1•min-1 | B. | V(O2)=3mol•L-1•min-1 | ||
| C. | V(SO3)=0.1mol•L-1•S-1 | D. | V(O2)=0.1mol•L-1•S-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 生成42.0 L N2(标准状况) | |
| B. | 转移电子的物质的量为1.25 mol | |
| C. | 有0.250 mol KNO3被氧化 | |
| D. | 被氧化的N原子的物质的量为3.75 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

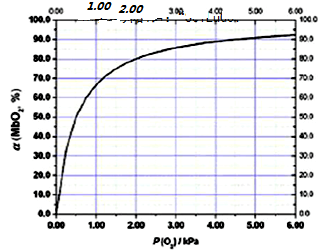
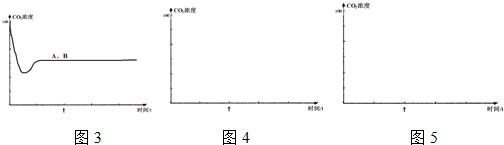
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
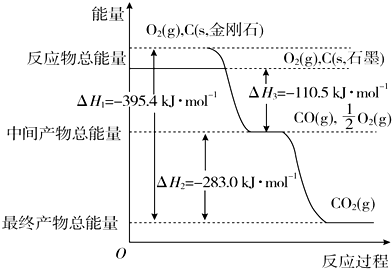
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com