
【题目】依据氧化还原反应:2Ag++Cu===Cu2++2Ag,设计的原电池如下图所示。
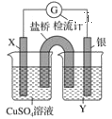
请回答下列问题:
(1)电极X的材料是________;Y是________。
(2)银电极为电池的________极,X电极上发生的电极反应为_____________________
【答案】Cu AgNO3溶液 正 Cu-2e-=Cu2+
【解析】
原电池是由两个半电池组成的,根据氧化还原反应2Ag++Cu=Cu2++2Ag可知,铜是负极,银是正极,负极上铜失电子发生氧化反应,正极上银离子得电子发生还原反应,则铜极应处于含有铜离子的可溶性盐溶液中,银处于含有银离子的可溶性银盐溶液中,电子从负极沿大小流向正极。
(1)根据电解质溶液中的阳离子与电极材料是同种金属的特点,可推知X是Cu,电解质溶液Y是AgNO3溶液,故答案为:Cu;AgNO3溶液;
(2)由于活动性Cu>Ag,结合原电池反应的原理可知银电极为电池的正极,电极反应式为Ag++e-=Ag,Cu电极上铜失电子发生氧化反应,电极反应式为Cu-2e-=Cu2+,故答案为:正;Cu-2e-=Cu2+。


科目:高中化学 来源: 题型:
【题目】某学生用0.10 mol·L-1标准NaOH溶液滴定某浓度的盐酸。记录数据如下:
实验 序号 | 待测液 体积/mL | 所消耗NaOH标准液的体积/mL | |
滴定前读数/mL | 滴定后读数/mL | ||
1 | 20.00 | 0.50 | 20.54 |
2 | 20.00 | 6.00 | 26.00 |
3 | 20.00 | 1.40 | 21.36 |

(1)滴定时选用酚酞试液作指示剂,如何判断滴定达到终点____________。
(2)滴定过程中,眼睛应注视_____________________;
(3)盐酸的物质的量浓度为___________。
(4)碱式滴定管尖嘴部分有气泡,滴定后消失,对测定结果的影响是__________(填“偏高”“偏低”或“无影响”)。
(5)某同学用已知准确浓度的高锰酸钾溶液滴定溶液中Fe2+的浓度,高锰酸钾溶液应盛放在________(填“甲”或“乙”)中,该反应的离子方程式为_______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国采用长征三号甲运载火箭成功发射了 “嫦娥一号” 卫星。肼(N2H4)是火箭发动机的一种燃料,反应时N2O4为氧化剂,反应生成N2和水蒸气。已知:N2(g)+2O2(g)=N2O4(g) △H =+8.7kJ/mol,N2H4(g)+O2(g)=N2(g)+2H2O(g) △H= -534kJ/mol
下列表示肼和N2O4反应的热化学方程式,正确的是 ( )
A.2N2H4(g) + N2O4(g) = 3N2(g) + 4H2O(l) △H=–1059.3 kJ/mo
B.N2H4(g) + ![]() N2O4(g) =
N2O4(g) =![]() N2(g) + 2H2O(g) △H=–542.7 kJ/mol
N2(g) + 2H2O(g) △H=–542.7 kJ/mol
C.2N2H4(g) + N2O4(g) = 3N2(g) + 4H2O(g) △H=–542.7 kJ/mol
D.2N2H4(g) + N2O4(g) = 3N2(g) + 4H2O(g) △H=–1076.7 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知NA为阿伏加德罗常数的值,下列说法正确的是
A. 3gCO2中含有的质子数为1.5NA
B. 1L0.1mol·L-1 Na2SiO3溶液中含有的SiO32-数目为0.1NA
C. 0.1molH2O2分解产生O2时,转移的电子数为0.2NA
D. 2.8g聚乙烯中含有的碳碳双键数目为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解原理在化学工业中有广泛应用。右图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题:

(1)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则
①电解池中X极上的电极反应是______________。在X极附近观察到的现象是______________________________。
②Y电极上的电极反应式是______________。检验该电极反应产物的方法是______________。
(2)如要用电解方法精炼粗铜,电解液a选用CuSO4溶液,则
①X电极的材料是___________________,电极反应式是______________。
②Y电极的材料是___________________,电极反应式是______________。
(说明:杂质发生的电极反应不必写出)
③假若电路中有0.04摩尔电子通过时,阴极增重________克。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知重铬酸钾(K2Cr2O7)具有强氧化性,其还原产物Cr3+在水溶液中呈绿色或蓝绿色。在K2Cr2O7溶液中存在下列平衡:Cr2O72(橙色) + H2O![]() 2CrO42(黄色) + 2H+。用K2Cr2O7溶液进行下列实验:结合实验,下列说法不正确的是( )
2CrO42(黄色) + 2H+。用K2Cr2O7溶液进行下列实验:结合实验,下列说法不正确的是( )
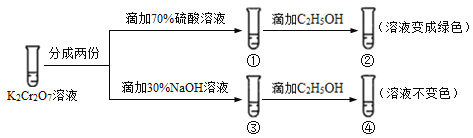
A.①中溶液橙色加深,③中溶液变黄
B.②中Cr2O72被C2H5OH还原
C.对比②和④可知K2Cr2O7酸性溶液氧化性强
D.若向④中加入70%H2SO4溶液至过量,溶液变为橙色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对含微量![]() 的某样品进行
的某样品进行![]() 化学定量测定,有以下两种途径,最后均是以淀粉作指示剂,用
化学定量测定,有以下两种途径,最后均是以淀粉作指示剂,用![]() 标准溶液滴定以求得
标准溶液滴定以求得![]() 的浓度。下列分析正确的是
的浓度。下列分析正确的是
已知:![]() 过量
过量![]()
方法一![]() 样品
样品![]()
![]()
![]() -
-![]()
![]()
![]()
![]()
![]()
方法二![]() 样品
样品![]()
![]() I2
I2![]()
![]()
A.方法二对样品所做处理操作简便,用作微量的测定更准确
B.当待测液由无色变为蓝色时即达到滴定终点
C.方法一与方法二测量出的样品浓度比为6:l
D.假设各步骤操作均得当,方法一所消耗![]() 标准溶液的体积是方法二的6倍
标准溶液的体积是方法二的6倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用石墨电极电解100 mL H2SO4与CuSO4的混合溶液,通电一段时间后,两极均收集到2.24 L气体(标准状况),则原混合溶液中Cu2+的物质的量浓度为( )
A.3 mol·L-1B.2 mol·L-1C.4 mol·L-1D.1 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应:![]()
![]()
![]() 某温度下,在4L密闭容器中加入纳米级
某温度下,在4L密闭容器中加入纳米级![]() 并通入
并通入![]()
![]() ,记录不同时间产生
,记录不同时间产生![]() 的物质的量如表:
的物质的量如表:
时间 | 20 | 40 | 60 | 80 |
|
|
|
|
|
下列说法正确的是
A.前20min的反应速率![]()
B.达平衡时,至少需要从外界吸收的能量为![]()
C.增大![]() ,可以提高水的分解率
,可以提高水的分解率
D.使用纳米级![]() 颗粒是为了提高催化效果
颗粒是为了提高催化效果
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com