
| A. | 0.1 mol•L-1FeCl3溶液中:K+、Na+、AlO2-、SCN- | |
| B. | 能溶解CaCO3的溶液中:Fe2+、Ca2+、Cl-、NO${\;}_{{3}_{\;}^{\;}}^{-}$ | |
| C. | 澄清透明的溶液中:Cu2+、Mg2+、SO${\;}_{4}^{2-}$、Cl- | |
| D. | 由水电离得到的c(H+)=1×10-13mol•L-1的溶液中:Mg2+、Cu2+、SO42-、NO3- |
分析 A.铁离子与偏铝酸根离子、硫氰根离子反应;
B.能溶解CaCO3的溶液中存在大量氢离子,硝酸根离子在酸性条件下能够氧化亚铁离子;
C.四种离子之间不反应,能够共存;
D.由水电离得到的c(H+)=1×10-13mol•L-1的溶液为酸性或碱性溶液,镁离子、铜离子与氢氧根离子反应.
解答 解:A.Fe3+与AlO2-、SCN-之间发生反应,在溶液中不能大量共存,故A错误;
B.能溶解CaCO3的溶液为酸性溶液,酸性溶液中Fe2+和NO3-发生氧化还原反应而不能大量共存,故B错误;
C.Mg2+、Cu2+、SO42-、Cl-之间不反应,在溶液中能够大量共存,故C正确;
D.由水电离得到的c(H+)=1×10-13mol•L-1的溶液中存在大量氢离子或氢氧根离子,Mg2+、Cu2+与氢氧根离子反应,在碱性溶液中不能大量共存,故D错误;
故选C.
点评 本题考查离子共存的判断,为高考的高频题,属于中等难度的试题,注意明确离子不能大量共存的一般情况,如:能发生复分解反应的离子之间;能发生氧化还原反应的离子之间;能发生络合反应的离子之间(如 Fe3+和 SCN-)等;还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;溶液的颜色,如无色时可排除 Cu2+、Fe2+、Fe3+、MnO4-等有色离子的存在;溶液的具体反应条件,如“氧化还原反应”、“加入铝粉产生氢气”;是“可能”共存,还是“一定”共存等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
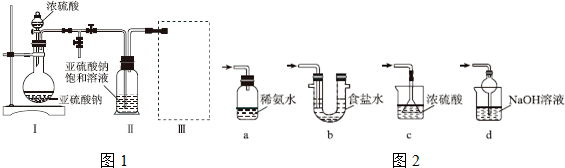

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用饱和NaHCO3溶液除CO2中的氯化氢气体 | |
| B. | SO2与乙烯的混合气体依次通入酸性高锰酸钾溶液、浓硫酸洗气后可得到纯净的SO2 | |
| C. | 用酒精萃取碘水中的碘单质 | |
| D. | 用CaO干燥Cl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
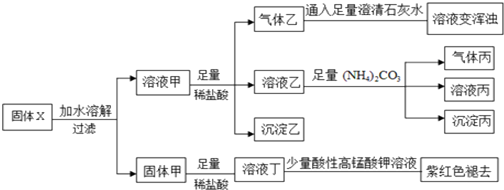
| A. | 气体乙和气体丙都为纯净物 | |
| B. | 固体粉末X中一定含有FeO、Na2S2O3、NaAlO2、Na2CO3,可能含有NaHCO3 | |
| C. | 溶液丁中的阳离子可能只含H+、Fe2+ | |
| D. | 溶液甲中一定含有AlO2-、CO32-、HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学反应速率:乙>甲 | B. | 平衡时O2的浓度:乙>甲 | ||
| C. | 平衡时SO2的转化率:乙>甲 | D. | 平衡时SO2的体积分数:乙>甲 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 物质$\left\{\begin{array}{l}{混合物}\\{纯净物\left\{\begin{array}{l}{溶液}\\{化合物}\end{array}\right.}\end{array}\right.$ | |
| B. | 纯净物$\left\{\begin{array}{l}{单质\left\{\begin{array}{l}{金属单质}\\{非金属单质}\end{array}\right.}\\{化合物}\end{array}\right.$ | |
| C. | 化合物$\left\{\begin{array}{l}{有机物}\\{无机物\left\{\begin{array}{l}{酸\left\{\begin{array}{l}{氧化物}\\{非氧化物}\end{array}\right.}\\{碱}\\{盐}\end{array}\right.}\end{array}\right.$ | |
| D. | 纯净物$\left\{\begin{array}{l}{无机物\left\{\begin{array}{l}{单质}\\{氧化物}\\{化合物}\end{array}\right.}\\{有机物}\end{array}\right.$ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com