
将物质的量均为a mol的Na和Al一同投入m g足量水中,所得溶液的密度为ρ g·cm-3,则此溶液的物质的量浓度为
A.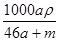 mol·L-1 mol·L-1 | B.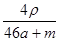 mol·L-1 mol·L-1 |
C. mol·L-1 mol·L-1 | D.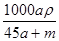 mol·L-1 mol·L-1 |
A
解析试题分析:将物质的量均为a mol的Na和Al一同投入m g足量水中,发生反应:2Na+2H2O=2NaOH+H2↑,2Al+2NaOH+2H2O=2NaAlO2+3H2↑,由方程式可知,a mol钠反应生成amol氢氧化钠,生成氢气0.5amol;amol氢氧化钠与amol铝恰好反应生成amol偏铝酸钠,同时生成氢气1.5amol;溶液为偏铝酸钠溶液,生成氢气的质量为(0.5amol+1.5amol)×2g/mol=4ag;溶液质量m(溶液)=m(金属)+m(H2O)-m(H2)=amol×23g/mol+amol×27g/mol+mg-4ag=(46a+m)g,所以溶液的体积为(46a+m)/ρmL,所以溶液的物质的量浓度为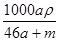 mol·L-1,选A。
mol·L-1,选A。
考点:考查物质的量浓度的计算。


 名师点拨卷系列答案
名师点拨卷系列答案 英才计划期末调研系列答案
英才计划期末调研系列答案科目:高中化学 来源: 题型:实验题
某研究小组为探究SO2和Fe(NO3)3溶液的反应的实验。设计了如下图所示装置进行实验.已知:1.0 mol/L的Fe(NO3)3溶液的pH=1
请回答:
(1)装置A中用于添加浓硫酸的仪器名称为 。
(2)实验前鼓入N2的目的是 。
(3)装置B中产生了白色沉淀,其成分是_______,说明SO2具有____性。
(4)分析B中产生白色沉淀的原因。
观点1:SO2与Fe3+反应;
观点2:在酸性条件下SO2与NO3-反应;
①若观点1正确,除产生沉淀外,还应观察到的现象是 。
②按观点2,装置B中反应的离子方程式是 。
③有人认为,如将装置B中的Fe(NO3)3溶液替换为等体积的下列溶液,在相同条件下进行实验,也可验证观点2是否正确。此时应选择的最佳试剂是(填序号) 。
| A.1 mol/L稀硝酸 |
| B.1.5 mol/L Fe(NO3)2溶液 |
| C.6.0 mol/L NaNO3溶液和0.2 mol/L盐酸等体积混合的溶液 |
| D.3.0 mol/L NaNO3溶液和0.1mol/L硫酸等体积混合的溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
对实验过程中出现的异常现象进行探究,是实施素质教育、培养创新精神的有效途经。
【实验1】用下图实验装置进行铜与浓硫酸的反应,实验中发现试管内除了产生白色硫酸铜固体外,在铜丝表面还有黑色固体甲生成,甲中可能含有黑色的CuO、CuS、Cu2S。查阅资料:CuS和Cu2S均为黑色固体,常温下都不溶于稀盐酸,在空气中煅烧,均转化为CuO和SO2。为了探究甲的成分,该小组同学在收集到足够量的固体甲后,进行了如下实验:

(1)上述实验装置除了有尾气吸收装置外,还有一个显著的优点是 。
(2)固体乙在空气中煅烧时,使用的实验仪器除了玻璃棒、三脚架、酒精灯外,还必须有 。
(3)确定乙是否煅烧完全的操作是 。
(4)煅烧过程中一定发生的化学反应方程式为 。
【实验2】某化学兴趣小组设计了如下实验装置(尾气吸收装置未画出),探究Cl2、Br2、Fe3+的氧化性强弱。
(5)根据下列实验操作和现象,填写实验结论。
| 实验操作 | 实验现象 | 结论 |
| 打开活塞a,向圆底烧瓶中滴入适量浓盐酸;然后关闭活塞a,点燃酒精灯。 | D装置中:溶液变红 E装置中:水层溶液变黄, 振荡后,CCl4层无明显变化。 | Cl2、Br2、Fe3+的氧化性由强到弱的顺序为: |
| ⅰ.(SCN)2性质与卤素单质类似。氧化性:Cl2>(SCN)2。 ⅱ.Cl2和Br2反应生成的BrCl呈红色,沸点约5℃,与水发生水解反应。 ⅲ.AgClO、AgBrO均可溶于水。 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
海水的综合利用可以制备金属钠和镁等,其流程如下图所示:
下列说法不正确的是 ( )
| A.海水提盐都属于物理变化 |
| B.利用母液可进一步提取溴,但要富集 |
| C.上述流程中生成Mg(OH)2沉淀的离子方程式为:Mg2++Ca(OH)2= Mg(OH)2+Ca2+ |
| D.不用电解MgO来制取镁是因为MgO熔点高,能耗大 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
相同物质的量的下列物质分别与等浓度的NaOH溶液反应,至体系中均无固体物质,消耗碱量最多的是( )
A.Al B.Al(OH)3 C.AlCl3 Al2O3
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
将一定质量的铁、氧化铁、氧化铜的混合物粉末放入100mL 4.40 mol/L盐酸中,充分反应后产生896 mL H2(标准状况),残留固体1.28g。过滤,滤液中无Cu2+。将滤液加水稀释到200mL,测得其中c(H+)为0.400mol/L。则原混合物中单质铁的质量是
| A.2.24g | B.3.36g | C.5.60g | D.10.08g |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
氧化亚铁粉末和铝粉配成铝热剂,分成两等份。一份在高温下恰好完全反应后,在与盐酸反应;另一份直接放入足量的烧碱溶液中充分反应。前后两种情况下生成的气体的质量比是
A.1:1 B.2:3 C. 3:2 D 28:9
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列物质的转化在给定条件下能实现的是
①SiO2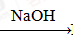 Na2SiO3
Na2SiO3 H2SiO3 ②Fe
H2SiO3 ②Fe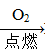 Fe2O3
Fe2O3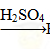 Fe2(SO4)3
Fe2(SO4)3
③BaSO4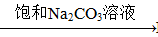 BaCO3
BaCO3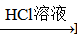 BaCl2 (Ksp(BaSO4)=1.1×10-10 Ksp(BaCO3)=2.6×10-9)
BaCl2 (Ksp(BaSO4)=1.1×10-10 Ksp(BaCO3)=2.6×10-9)
④AlCl3溶液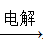 Al
Al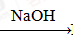 NaAlO2
NaAlO2
⑤HCHO HCOOH
HCOOH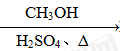 HCOOCH3
HCOOCH3
| A.①②⑤ | B.②③④ | C.②④⑤ | D.①③⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com