
| A. | 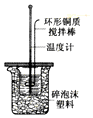 中和反应反应热的测得 | B. | 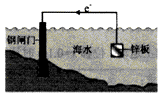 牺牲阳极的阴极保护法 | ||
| C. | 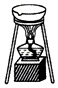 灼烧胆矾晶体测结晶水含量 | D. | 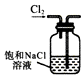 除去Cl2中混有的HCl气体 |
分析 A.测定中和热时,环形搅拌棒应该用玻璃的;
B.作原电池负极的金属被腐蚀,作原电池正极的金属被保护;
C.灼烧固体药品时应该用坩埚;
D.用洗气瓶洗气时,导气管应该遵循“长进短出”原则.
解答 解:A.测定中和热时,如果用铜质环形搅拌棒会导致热量散失,则测定中和热偏低,所以环形搅拌棒应该用玻璃的,故A错误;
B.作原电池负极的金属被腐蚀,作原电池正极的金属被保护,加入Zn后,Zn和钢闸门、海水构成原电池,Zn易失电子作负极,钢闸门作正极而被保护,该方法为牺牲阳极的阴极保护法,故B正确;
C.灼烧固体药品时应该用坩埚,不能用蒸发皿,蒸发皿只能蒸发溶液,故C错误;
D.用洗气瓶洗气时,导气管应该遵循“长进短出”原则,否则会将洗气瓶中溶液排出,故D错误;
故选B.
点评 本题考查化学实验方案评价,为高频考点,涉及仪器选取、原电池原理、化学实验原理等知识点,明确化学反应原理、物质性质是解本题关键,C选项为易错点.


科目:高中化学 来源: 题型:选择题
| A. | Y4X10分子中,极性键和非极性键的个数比为10:4 | |
| B. | Z和W形成的多种化合物中只有一种能与水反应 | |
| C. | 25℃时,Z、W、X按原子个数比2:3:4形成的化合物的水溶液的pH=7 | |
| D. | 25℃时,等浓度的Z和Q的最高价氧化物对应水化物的水溶液中,水电离的c(H+)相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
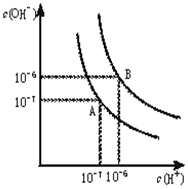 水的电离平衡曲线如下图所示.
水的电离平衡曲线如下图所示.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 下图是部分短周期元素化合价与原子序数的关系图,请回答下列问题:
下图是部分短周期元素化合价与原子序数的关系图,请回答下列问题: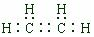 .
. ,A是一种常用的还原剂.向装有少量AgBr的试管中加入A的溶液,可观察到固体逐渐变黑,并有气泡产生,写出该反应的化学方程式4AgBr+N2H4=4Ag+N2↑+4HBr.b与c按原子数2和4构成分子B,已知A和B反应时生成无毒害物质,则该反应中氧化剂与还原剂的物质的量之比为1:2.
,A是一种常用的还原剂.向装有少量AgBr的试管中加入A的溶液,可观察到固体逐渐变黑,并有气泡产生,写出该反应的化学方程式4AgBr+N2H4=4Ag+N2↑+4HBr.b与c按原子数2和4构成分子B,已知A和B反应时生成无毒害物质,则该反应中氧化剂与还原剂的物质的量之比为1:2.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
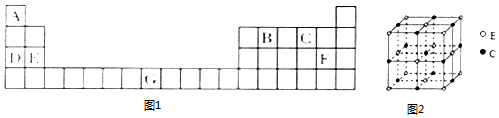
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 军舰船底镶嵌锌块作正极,以防船体被腐蚀 | |
| B. | “天宫二号”使用的碳纤维,是一种新型有机高分子材料 | |
| C. | 烈性炸药硝化甘油是由甘油(丙三醇)硝化制得,它属于酯类 | |
| D. | 蚊虫叮咬时释放出的蚁酸使人觉得不适,可以用肥皂水氧化蚁酸处理 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “84”消毒液中的NaClO有强氧化性,可杀菌消毒 | |
| B. | 使用Na2CO3溶液比使用洗涤剂淸洗餐具更环保 | |
| C. | 铝、氧化铝烧结成的金属陶瓷能耐高温、不易破碎 | |
| D. | 钙、铁、锌、铜、碘是人体必需的微量元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2 mol•L-1的AlC13溶液中含有Al3+的数目小于2NA | |
| B. | 用石灰乳完全吸收1 molCl2时,转移的电子数为2 NA | |
| C. | 标准状况下,1 mol CH3Cl中含有的共价键数目为4 NA | |
| D. | 标准状况下,分子数均为NA 的O2与NO混合后,气体的体积约为44.8 L |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com