
【题目】对于Fe+2HCl=FeCl2+ H2↑反应,下列说法不正确的是( )
A.Fe是还原剂,被氧化
B.HCl是氧化剂,发生了还原反应
C.-1价氯在反应中价态未变,所以HCl既不是氧化剂,又不是还原剂
D.此反应既是置换反应又是氧化还原反应
科目:高中化学 来源: 题型:
【题目】以粉煤灰(主要成分为Al2O3和SiO2,还含有少量的FeO、Fe2O3等)为原料制备Al2O3的流程如下:

(1)“酸浸”时需加入过量的稀硫酸,目的是提高浸取率和________;滤渣的主要成分是__________。
(2)“氧化”过程中,加入H2O2发生反应的离子方程式为____________。
(3)“提纯”过程中,当加入NaOH溶液达到沉淀量最大时,溶液中c(SO42-)∶c(Na+)=_________。
(4)已知Ksp[Fe(OH)3]=1×10-39。“提纯”过程中,当c(Fe3+)<10-6 mol ·L-1时,溶液中c(OH-)>________mol ·L-1。
(5)“沉淀”过程中,通入过量CO2时发生反应的化学方程式为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2SO2(g)+O2(g)=2SO3(g)反应过程的能量变化如图所示。已知1mol SO2(g)氧化为1mol SO3的 ΔH=—99kJ·mol-1。请回答下列问题:
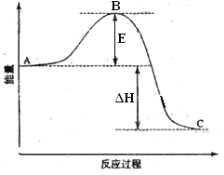
(1)图中A、C分别表示________、_________,E的大小对该反应的反应热有无影响?_______。该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低?_________,理由是_________________________。
(2)图中△H=____________kJ·mol-1。
(3)如果反应速率υ(SO2)为0.05 mol·L-1·min-1,则υ(O2)=_________υ(SO3)=___________。
(4)已知单质硫的燃烧热为296 kJ·mol-1,计算由S(s)生成3 molSO3(g)的△H(要求写出计算过程)_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作能达到目的的是( )

A. 用甲装置验证浓H2SO4的脱水性、强氧化性
B. 用乙装置收集NO气体
C. 装置丙中水能持续流下,说明装置气密性不良好
D. 用丁装置比较N、C、Si非金属性的强弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答下列问题:
(1)深埋在潮湿土壤中的铁管道,在硫酸盐还原菌(该还原菌最佳生存环境在pH为7~8之间)作用下,能被 SO42-腐蚀,其电化学腐蚀原理如下图所示, 写出正极的电极反应式__________。

(2)在1800K时
2Fe(s)+3/2O2(g)=Fe2O3(s) △H1=-354.2kJ/mol
3Fe(s)+O2(g)=Fe3O4(s) △H2=-550.9kJ/mol
则反应:2Fe3O4(s)+1/2O2(g)=3Fe2O3(s) 的△H 为____kJ/mol
(3)Fe3+和I-在水溶液中的反应如下:2I-+ 2Fe3+![]() 2Fe2+ +I2(在水溶液中)。298K 时,向 5mL0.1mol/L的 KI 溶液中滴加 0.1 mol/L FeCl3 溶液,得到 c(Fe2+)与加入FeCl3 溶液体积关系如下图所示:该温度下滴加 5mLFeCl3溶液时,Fe3+的平衡转化率 =____ %, 平衡常数 K=_____
2Fe2+ +I2(在水溶液中)。298K 时,向 5mL0.1mol/L的 KI 溶液中滴加 0.1 mol/L FeCl3 溶液,得到 c(Fe2+)与加入FeCl3 溶液体积关系如下图所示:该温度下滴加 5mLFeCl3溶液时,Fe3+的平衡转化率 =____ %, 平衡常数 K=_____

(4)在773 K时,分别将2 mol N2和6 mol H2充入一个固定容积为1 L的密闭容器中,随着反应的进行,气体混合物中n(H2)、n(NH3)与反应时间t的关系如下表:
t/min | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
n(H2)/mol | 6.00 | 4.50 | 3.60 | 3.30 | 3.03 | 3.00 | 3.00 |
n(NH3)/mol | 0 | 1.00 | 1.60 | 1.80 | 1.98 | 2.00 | 2.00 |
该温度下,若向同容积的另一容器中投的N2、H2、NH3的浓度分别为3 mol·L-1、3 mol·L-1、3 mol·L-1,则此时v正________(填大于小于等于v逆。由上表中的实验数据计算得到浓度-时间的关系可用下图中的曲线表示,表示c(N2)-t的曲线是____________。在此温度下,若起始充入4 mol N2和12 mol H2,则反应刚达到平衡时,表示c(H2)-t的曲线上相应的点为_________________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化还原反应是一类重要的反应,在工农业生产、日常生活中都有广泛的用途。
(1)火药是中国的“四大发明”之一,永远值得炎黄子孙骄傲。黑火药在发生爆炸时,发生如下反应:2KNO3+3C+S=K2S+N2↑+3CO2↑。其中被氧化的元素是____________,还原产物是____________。
(2)实验室为监测空气中汞蒸气的含量,往往悬挂涂有CuI的滤纸,根据滤纸是否变色或颜色发生变化所用去的时间来判断空气中的含汞量,其反应为4CuI+Hg=Cu2HgI4+2Cu。
①上述反应产物Cu2HgI4中,Cu元素显________价。
②以上反应中的氧化剂为________,当有1 mol CuI参与反应时,转移电子________mol。
③标明上述反应电子转移的方向和数目。____________________________。
(3)工业上常用酸性高锰酸钾溶液处理含有CuS和Cu2S的矿物,其反应原理如下:
8MnO4—+5Cu2S+44H+=10Cu2++5SO2↑+8Mn2++22H2O
6MnO4—+5CuS+28H+=5Cu2++5SO2↑+6Mn2++14H2O
根据上述反应原理,某学习小组用400 mL 0.075 mol·L-1的酸性高锰酸钾溶液处理2 g含有CuS和Cu2S的混合物。反应后煮沸溶液,赶尽SO2,剩余的KMnO4恰好与350 mL 0.1 mol·L-1的(NH4)2Fe(SO4)2溶液完全反应。
①配平KMnO4与(NH4)2Fe(SO4)2反应的离子方程式:______,MnO![]() +Fe2++H+=Mn2++Fe3++H2O
+Fe2++H+=Mn2++Fe3++H2O
②KMnO4溶液与固体混合物反应后,剩余KMnO4的物质的量为________ mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在给定条件下,下列离子组的离子共存判断及反应的离子方程式均正确的是( )
选项 | 条件 | 离子组 | 离子共存判断及的离子方程式 |
A | c(OH-)c(H+)=1酸性溶液中 | Fe2+、NO3-、Al3+、CO32- | 不能大量共存,3Fe2++4H++NO3-=3Fe3++NO↑+2H2O |
B | 由水电离出c(H+) =1×10-13mol·L-1 | K+、NH4+、Cl-、[Al(OH)4]- | 能大量共存 |
C | 有大量Fe3+的溶液 | Na+、NH4+、SO42-、Cl- | 能大量共存 |
D | 通入少量SO2气体 | K+、Na+、ClO-、SO42- | 不能大量共存,2ClO-+SO2+H2O=2HClO+SO32- |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分类是学习和研究化学的一种重要方法,下列分类合理的是( )
A.K2CO3和Na2O都属于盐B.H2SO4和HNO3都属于酸
C.KOH和Na2CO3都属于碱D.Na2O和Na2SiO3都属于氧化物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com