
五种短周期元素的某些性质如表所示(其中Z、M、W为同周期元素)。
| 元素代号 | Y | X | W | M | Z |
| 原子半径(×10-12 m) | 64 | 73 | 78 | 96 | 113 |
| 主要化合价 | -1 | +5、-3 | +7、-1 | +4、-4 | +3 |
下列说法不正确的是( )
A.由M与W形成的化合物是含有极性键的极性分子
B. X与M之间形成的化合物,其晶体是原子晶体
C.由M元素形成的晶体,是太阳能光伏发电的主要材料,工业上制取M单质,可通过置换反应原理来生产
D.Y与Z元素形成的[ZY6]3-,离子中存在配位键,该离子构型呈正八面体
【知识点】原子结构与元素周期律的关系
【答案解析】A 解析:原子的电子层数越大,其原子半径越大,同一周期元素中,原子半径随着原子序数增大而减小,在短周期元素中,元素的最高正化合价与其族序数相等,最低负化合价=族序数-8,根据表中数据知,Y的原子半径最小,且其主要化合价为-1,则X是F元素;则W为Cl元素;W、M、Z为同周期元素,根据半径大小可判断:Z为Al元素,M为Si元素,X原子半径只大于Y,所以X是N元素;
A.由M与W形成的化合物是SiCl4,结构与CCl4相似,是含有极性键的非极性极性分子,故A错误; B.X与M之间形成的化合物是Si3N4,其构成微粒是原子,原子间以共价键相结合构成原子晶体,故B正确; C.Si是良好的半导体材料,可用于太阳能光伏发电,工业上可通过碳置换二氧化硅反应原理来生产,故C正确; D.Y与Z元素形成的[ZY6]3-,Al、F之间既有极性共价键,也有配位键,故D正确;
故答案选A
【思路点拨】本题考查了原子结构和元素周期律的关系,根据元素的原子半径、化合价结合元素周期律来推断元素,正确推断元素是解本题关键,再结合物质的结构来分析解答


科目:高中化学 来源: 题型:
下列说法正确的是( )
A.室温下,在水中的溶解度:丙三醇>苯酚>1-氯丁烷
B.用核磁共振氢谱不能区分HCOOCH3和HCOOCH2CH3
C.用Na2CO3溶液不能区分CH3COOH和CH3COOCH2CH3
D.油脂在酸性或碱性条件下均可发生水解反应,且产物相同
查看答案和解析>>
科目:高中化学 来源: 题型:
卤素单质及其化合物在生产和生活中有广泛应用。
Ⅰ、氟化钠主要用作农作物杀菌剂、杀虫剂、木材防腐剂。实验室以氟硅酸(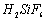 )等物质为原料、通过下图所示的流程制取较纯净的氟化钠,并得到副产品氯化铵:
)等物质为原料、通过下图所示的流程制取较纯净的氟化钠,并得到副产品氯化铵:
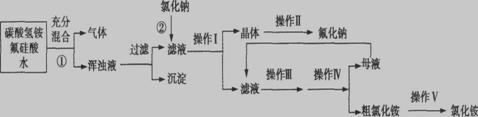
已知:20℃时氯化铵的溶解度为37.2 g,氟化钠的溶解度为4 g,Na2SiF6微溶于水。
请回答下列有关问题:
(1)完成并配平上述流程中①、②的化学反应方程式:
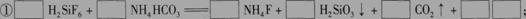
② 。
(2)操作Ⅲ分为两步,其顺序是 (填写所选序号)。
a、过滤 b、加热浓缩 c、冷却结晶 d、洗涤
操作Ⅱ是洗涤、干燥,其目的是 ,在操作Ⅰ~V中与之相同的操作步骤是 。
(3)流程①中NH4HCO3必须过量,其原因是 。
Ⅱ、紫菜与海带类似,是一种富含生物碘的海洋植物,可用于食用补碘。以下为某兴趣小组模拟从紫菜中提取碘的过程:

已知:商品紫菜轻薄松脆,比海带更易被焙烧成灰(此时碘转化为碘化物无机盐)。
(4)将焙烧所得的紫菜灰与足量的双氧水和稀硫酸作用,写出反应的离子方程式: 。
(5)操作①中涉及两步操作,名称是 ,所用的主要玻璃仪器为 ,所用试剂A最好选用表格中的 (填试剂名称)。
| 乙醇 | 四氯化碳 | 裂化汽油 | 碘(晶体) | |
| 密度/g、cm-3 | 0.7893 | 1.595 | 0.71~0.76 | 4.94 |
| 沸点/℃ | 78.5 | 76.8 | 25~232 | 184.35 |
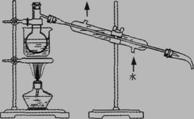
(6)将下列装置图中缺少的必要仪器补画出来,以最终将单质碘与试剂A分离:
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y、Z、W为四种短周期主族元素,其中X、Z
同族,Y、Z同周期,W是短周期主族元素中原子半径最大的,X原子最外层电子数是核外电子层数的3倍,Y的最高正价与最低负价代数和为6。下列说法正确的是( )
A.Y元素最高价氧化物对应的水化物化学式H2YO4
B.原子半径由小到大的顺序为: X< Z < Y
C.Y、Z两种元素气态氢化物中,Z的气态氢化物最稳定
D.X与W形成的两种化合物中,阴、阳离子物质的量之比均为1:2
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
A.含有离子键和共价键的化合物一定是离子化合物
B.元素原子的最外层电子数等于该元素的最高正化合价
C.目前人们已发现的元素种类数目与原子种类数目相同
D.多电子原子中,在离核较近的区域内运动的电子能量较高
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式正确的是( )
A.碳酸钙中加入盐酸:CO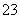 +2H+===CO2↑+H2O
+2H+===CO2↑+H2O
B.澄清石灰水与盐酸反应:Ca(OH)2+2H+===Ca2++2H2O
C.三氯化铁溶液与铁反应:2Fe3++Fe===3Fe2+
D.氯化亚铁溶液中通入少量氯气:Fe2++Cl2===Fe3++2Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
某学校的实验室有一瓶碳酸氢钠,由于放置时间过久,不知是否变质。
(1)请你利用所学过的知识,设计一个简单的实验,确定这瓶碳酸氢钠是否变质。你设计的实验方案:_____________________________________________。
(2)如果变质了,请你设计实验方案,确定其是否完全变质。你设计的实验方案:____________________________________________________________________________
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组中的两种物质相互反应时,无论哪种过量,都可以用同一个离子方程式表示的是( )
①碳酸钠溶液与盐酸 ②偏铝酸钠溶液与盐酸③二氧化碳与氢氧化钠溶液
④硝酸银溶液和氨水 ⑤氯化铝与氨水 ⑥碳酸氢钠溶液与澄清石灰水
A.③⑤ B.①③⑥ C.仅有⑤ D.②④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com