
A、B、C、D、E、F是短周期元素,周期表中A与B、B与C相邻,C与E同主族,A与C最外层电子数之比为2:3,B的最外层电子数比C的最外层电子数少1个; F元素的原子在周期表中半径最小;常见化合物D2C2与水反应生成C的单质,且溶液使酚酞溶液变红。
(1)E的名称为______;D的最高价氧化物的水化物的电子式:_________。FAB分子的结构式为_____
(2)A、B、C的氢化物稳定性顺序为(用分子式表示,由大到小)___________________;B的氢化物和B的最高价氧化物的水化物反应生成Z,则Z中的化学键类型为____________________。
(3)两种均含C、D、E、F四种元素的化合物相互反应放出气体的反应离子方程式为____________。
(4)一定量的D2C2与AC2反应后的固体物质,恰好与含0.8mol HCl的稀盐酸完全反应,并收集0.25 mol 气体,则固体物质的组成为(写清成分和物质的量)______________________。
(5)在容积不变的密闭容器中进行如下反应:3F2(g)+B2(g) 2BF3(g),若将平衡体系中各物质的浓度都增加到原来的2倍,则产生的结果是______________________(填序号)。
2BF3(g),若将平衡体系中各物质的浓度都增加到原来的2倍,则产生的结果是______________________(填序号)。
A.平衡不发生移动 B.反应物的转化率减小
C.BF3的质量分数增加 D.正逆反应速率都增大
(1)硫
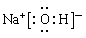
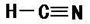
(2)H2O>NH3 >CH4 离子键、共价键
(3)HSO3-+H+=H2O+SO2
(4)0.3molNa2O2 0.1mol Na2CO3
(5) C、D
【解析】
试题分析:化合物D2C2与水反应生成C的单质,且所得溶液显碱性,则可推知D2C2为Na2O2,即D为Na,C为O;A与C最外层电子数之比为2:3,且A与B相邻,B与C相邻,B的最外层电子数比C的最外层电子数少1个,则A为C,B为N;E与C同主族,则E为S,F的原子半径最小,则F为H。
(1)E为硫元素;Na的最高价氧化物对应水化物为NaOH;FAB是HCN。
(2)非金属性越强,其氢化物越稳定,因此氢化物的稳定性由大到小为H2O>NH3 >CH4。Z为NH4NO3,属于离子化合物,硝酸根中含有共价键。
(3)符合条件的物质是NaHSO4和NaHSO3。
(4)混合物与含0.8mol HCl的稀盐酸完全反应,根据原子守恒可知c(Na)=0.8mol,若反应后固体全是Na2CO3,则反应后生成CO2气体的物质的量为0.4mol,而实际只收集到0.25mol气体,则说明与Na2O2反应的CO2不足,Na2O2有剩余,因此收集到的气体是O2和CO2的混合气体,固体成分是Na2O2和Na2CO3。设混合物中Na2O2的物质的量为x,Na2CO3的物质的量为y,根据 Na2CO3~CO2,2Na2O2~O2,则有2x+2y=0.8mol,x/2+y=0.25mol,解得x=0.3mol,y=0.1mol。
(5)设原平衡时H2、N2、NH3的物质的量浓度分别为a、b、c,则该温度下的平衡常数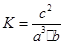 ,温度不变的情况下浓度增大到原来的2倍,则
,温度不变的情况下浓度增大到原来的2倍,则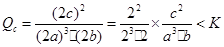 ,因此平衡正向移动,反应物转化率增大,A、B错,C正确;物质浓度增大,正、逆反应速率都增大,的正确。
,因此平衡正向移动,反应物转化率增大,A、B错,C正确;物质浓度增大,正、逆反应速率都增大,的正确。
考点:考查元素周期律、元素周期表,元素化合物性质,化学计算,影响化学平衡因素等。


 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案科目:高中化学 来源: 题型:阅读理解
| 氟化物 | X | Y | Z |
| 熔点/K | 1266 | 1534 | 183 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 [化学/选修/物质结构与性质]A、B、C、D、E五种短周期元素,原子序数依次增大,各元素对应的单质均为固体.A、C、E三元素的原子核外均只有2个未成对电子.B、E元素的原子序数之和等于C、D元素的原子序数之和.
[化学/选修/物质结构与性质]A、B、C、D、E五种短周期元素,原子序数依次增大,各元素对应的单质均为固体.A、C、E三元素的原子核外均只有2个未成对电子.B、E元素的原子序数之和等于C、D元素的原子序数之和.查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
| 1 |
| 2 |
| 3 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com