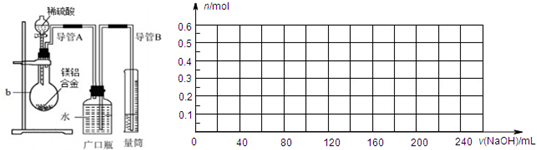
(1)质量分数为0.365密度为1.19g/cm3的浓盐酸,计算该盐酸的物质的量浓度;
(2)取上述盐酸50ml,稀释成100mL溶液,加入15g CaCO3充分产生的气体体积在标准状况下是多少?
(3)将上述产生的气体全部通入500mL浓度为0.4mol/L的NaOH溶液中完全反应,所得溶液的组成是什么?求其物质的量浓度.
【答案】
分析:(1)根据c=
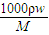
计算溶液的物质的量浓度;
(2)计算盐酸和碳酸钙的物质的量,判断是否完全反应,进而计算生成二氧化碳的体积;
(3)根据二氧化碳的物质的量和NaOH的物质的量,利用质量守恒计算.
解答:解:(1)c=
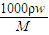
=
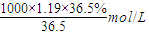
=11.9mol/L,
答:该盐酸的物质的量浓度为11.9mol/L;
(2)取上述盐酸50ml,稀释成100mL溶液,则溶质的物质的量为:11.9mol/L×0.05L=0.595mol,
15g CaCO
3的物质的量为:
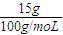
=0.15mol,
反应的方程式为:CaCO
3+2HCl═CaCl
2+CO
2↑+H
2O,由方程式可知盐酸过量,设生成的二氧化碳的体积为V,则
CaCO
3+2HCl═CaCl
2+CO
2↑+H
2O
1mol 22.4L
0.15mol V
V=
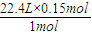
=3.36L
答:加入15g CaCO
3充分产生的气体体积在标准状况下是3.36L.
(3)500mL浓度为0.4mol/L的NaOH的物质的量为:n(NaOH)=c?V=0.5L×0.4mol/L=0.2mol,反应产物分别为NaHCO
3和Na
2CO
3,
发生反应分别为:2NaOH+CO
2═Na
2CO
3+H
2O;NaOH+CO
2═NaHCO
3 设生成Na
2CO
3xmol,NaHCO
3ymol,
则:
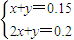
解之得:x=0.05,y=0.1
所以:c(NaHCO
3)=
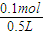
=0.2mol/L,c(Na
2CO
3)=
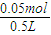
=0.1mol/L
答:所得溶液的组成是NaHCO
3和Na
2CO
3,浓度分别为NaHCO
3为0.2mol/L,Na
2CO
3为0.1mol/L.
点评:本题考查物质的量的有关计算,题目难度不大,但易错,注意把握物质的量与质量、浓度以及溶液物质的量浓度的有关计算公式的运用,本题的关键是判断反应的程度.

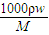 计算溶液的物质的量浓度;
计算溶液的物质的量浓度;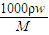 =
=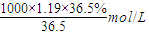 =11.9mol/L,
=11.9mol/L,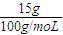 =0.15mol,
=0.15mol,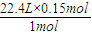 =3.36L
=3.36L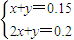
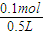 =0.2mol/L,c(Na2CO3)=
=0.2mol/L,c(Na2CO3)=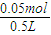 =0.1mol/L
=0.1mol/L