
下列说法中,不符合ⅦA族元素性质特征的是( )
A.从上到下原子半径逐渐减小
B.易形成-1价离子
C.从上到下单质的氧化性逐渐减弱
D.从上到下氢化物的稳定性依次减弱
科目:高中化学 来源: 题型:
乙醇是重要的有机化工原料,可由乙烯气相直接水合法或间接水合法生产。回答下列问题:
(1)间接水合法是指先将乙烯与浓硫酸反应生成硫酸氢乙酯(C2H5OSO3H),再水解生成乙醇。写出相应反应的化学方程式_____________________________________________
________________________________________________________________________。
(2)已知:
甲醇脱水反应2CH3OH(g)===CH3OCH3(g)+H2O(g)
ΔH1=-23.9 kJ·mol-1
甲醇制烯烃反应2CH3OH(g)===C2H4(g)+2H2O(g)
ΔH2=-29.1 kJ·mol-1
乙醇异构化反应C2H5OH(g)===CH3OCH3(g)
ΔH3=+50.7 kJ·mol-1
则乙烯气相直接水合反应C2H4(g)+H2O(g)===C2H5OH(g)的ΔH=______________ kJ·mol-1。
与间接水合法相比,气相直接水合法的优点是_____________________________________
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
374 ℃、22.1 MPa以上的超临界水具有很强的溶解有机物的能力,并含有较多的H+和OH-,由此可知超临界水 ( )
A.显中性,pH等于7
B.表现出非极性溶剂的特性
C.显酸性,pH小于7
D.表现出极性溶剂的特性
查看答案和解析>>
科目:高中化学 来源: 题型:
重铬酸铵[(NH4)2Cr2O7]是一种橘黄色晶体,可用作有机合成催化剂、实验室制纯净的N2及Cr2O3等。实验室可由工业级铬酸钠(Na2CrO4)制取重铬酸铵。有关物质的溶解度如图所示。

实验步骤如下:
步骤1:将铬酸钠溶于适量的水,加入一定量浓硫酸酸化,使铬酸钠转化为重铬酸钠。
步骤2:将上述溶液蒸发结晶,并趁热过滤。
步骤3:将步骤2得到的晶体再溶解,再蒸发结晶并趁热过滤。
步骤4:将步骤2、3得到的滤液冷却至40 ℃左右进行结晶,用水洗涤,获得重铬酸钠晶体。
步骤5:将步骤4得到的重铬酸钠和氯化铵按物质的量之比1∶2 溶于适量的水中,加热至105~110 ℃,让其充分反应。
(1)步骤1是一个可逆反应,该反应的离子方程式为_____________。
(2)步骤2、3的主要目的是_______________________________________。
(3)步骤4在40 ℃左右结晶,其主要目的是________________________________。
(4)步骤5获得(NH4)2Cr2O7还需补充的操作有_________________________________。
(5)(NH4)2Cr2O7受热分解制取Cr2O3的化学方程式为_____________________________。
(6)对上述产品进行检验和含量测定。
①检验产品中是否含有K+的实验方法是_________________________________。
②为了测定上述产品中(NH4)2Cr2O7的含量,称取样品0.150 0 g,置于锥形瓶中,加50 mL水,再加入2 g KI(过量)及稍过量的稀硫酸溶液,摇匀,暗处放置10 min,然后加150 mL蒸馏水并加入3 mL 0.5%淀粉溶液,用0.100 0 mol·L-1 Na2S2O3标准溶液滴定至终点,消耗Na2S2O3标准溶液30.00 mL,则上述产品中(NH4)2Cr2O7的纯度为__________(假定杂质不参加反应,已知:Cr2O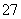 +6I-+14H+===2Cr3++3I2+7H2O,I2+2S2O
+6I-+14H+===2Cr3++3I2+7H2O,I2+2S2O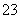 ===2I-+S4O
===2I-+S4O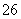 )
)
查看答案和解析>>
科目:高中化学 来源: 题型:
第四周期中,未成对电子数最多的元素是__________。(填名称)
(1)它位于第________族。
(2)核外电子排布式是________。
(3)它有________个能层,________个能级,__________种运动状态不同的电子。
(4)价电子排布式________,价电子排布图__________。
(5)属于________区。
查看答案和解析>>
科目:高中化学 来源: 题型:
Cu+基态核外电子排布式为
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
前四周期原子序数依次增大的元素A、B、C、D中,A和B的价电子层中未成对电子均只有1个,并且A-和B+的电子数相差为8;与B位于同一周期的C和D,它们价电子层中的未成对电子数分别为4和2,且原子序数相差为2。
四种元素中的第一电离能最小的是__________,电负性最大的是__________。(填元素符号)
查看答案和解析>>
科目:高中化学 来源: 题型:
已知X、Y是主族元素,I为电离能,单位是kJ·mol-1。请根据下表数据判断,错误的是 ( )
| 元素 | I1 | I2 | I3 | I4 |
| X | 500 | 4 600 | 6 900 | 9 500 |
| Y | 580 | 1 800 | 2 700 | 11 600 |
A.元素X的常见化合价是+1价
B.元素Y是ⅡA族元素
C.元素X与氯形成化合物时,化学式可能是XCl
D.若元素Y处于第三周期,它可与冷水剧烈反应
查看答案和解析>>
科目:高中化学 来源: 题型:
研究氮氧化物与悬浮在大气中海盐粒子的作用时,涉及如下反应:
2NO2(g)+NaCl(s)??NaNO3(s)+ClNO(g) K1
ΔH1<0 (Ⅰ)
2NO(g)+Cl2(g)??2ClNO(g) K2
ΔH2<0 (Ⅱ)
实验室可用NaOH溶液吸收NO2,反应为2NO2+2NaOH===NaNO3+NaNO2+H2O。含0.2 mol NaOH的水溶液与0.2 mol NO2恰好完全反应得1 L溶液A,溶液B为0.1 mol·L-1的CH3COONa溶液,则两溶液中c(NO )、c(NO
)、c(NO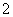 )和c(CH3COO-)由大到小的顺序为________。(已知HNO2的电离常数Ka=7.1×10-4mol·L-1,CH3COOH的电离常数Ka=1.7×10-5mol·L-1)
)和c(CH3COO-)由大到小的顺序为________。(已知HNO2的电离常数Ka=7.1×10-4mol·L-1,CH3COOH的电离常数Ka=1.7×10-5mol·L-1)
可使溶液A和溶液B的pH相等的方法是________。
a.向溶液A中加适量水
b.向溶液A中加适量NaOH
c.向溶液B中加适量水
d.向溶液B中加适量NaOH
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com