
在基态多电子原子中,关于核外电子能量的叙述错误的是 ( )。
A.最易失去的电子能量最高
B.电离能最小的电子能量最高
C.p轨道电子能量一定高于s轨道电子能量
D.在离核最近区域内运动的电子能量最低
 出彩同步大试卷系列答案
出彩同步大试卷系列答案科目:高中化学 来源: 题型:
氯气可以用来消灭田鼠,使用方法是将氯气通过软管灌入田鼠洞中,这是利用了氯气以下性质中的①黄绿色 ②密度比空气大 ③有毒 ④较易液化 ⑤能溶解于水
A.①②③ B.②③ C.③④ D.③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
已知难溶电解质在水溶液中存在溶解平衡:
MmAn(s)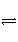
 mMn+(aq)+nAm-(aq)
mMn+(aq)+nAm-(aq)
Ksp=[Mn+]m·[Am-]n,称为溶度积。
某学习小组欲探究CaSO4沉淀转化为CaCO3沉淀的可能性,查得如下资料:(25℃)
| 难溶电 解质 | CaCO3 | CaSO4 | MgCO3 | Mg(OH)2 |
| Ksp | 2.8×10-9 mol-2·L-2 | 9.1×10-6 mol-2·L-2 | 6.8×10-6 mol-2·L-2 | 1.8×10-12 mol-3·L-3 |
实验步骤如下:
①往100 mL 0.1 mol·L-1的CaCl2溶液中加入100 mL 0.1 mol·L-1的Na2SO4溶液,立即有白色沉淀生成。
②向上述悬浊液中加入固体Na2CO3 3 g,搅拌,静置,沉淀后弃去上层清液。
③再加入蒸馏水搅拌,静置,沉淀后再弃去上层清液。
④________________________________________________________________________。
(1)由题中信息知Ksp越大,表示电解质的溶解度越______(填“大”或“小”)。
(2)写出第②步发生反应的化学方程式:
________________________________________________________________________
________________________________________________________________________。
(3)设计第③步的目的是
________________________________________________________________________。
(4)请补充第④步操作及发生的现象:
________________________________________________________________________
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定条件下,PbO2与Cr3+反应,产物是Cr2O 和Pb2+,则与1 mol Cr3+反应所需PbO2的物质的量为( )
和Pb2+,则与1 mol Cr3+反应所需PbO2的物质的量为( )
A.3 mol B.1.5 mol
C.1 mol D.0.75 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
现有四种元素的基态原子的电子排布式如下:
①1s22s2 2p63s23p4;②1s22s22p63s23p3;
③1s22s2 2p3;④1s22s22p5。
则下列有关比较中正确的是 ( )。
A.第一电离能:④>③>②>①
B.原子半径:④>③>②>①
C.电负性:④>③>②>①
D.最高正化合价:④>③=②>①
查看答案和解析>>
科目:高中化学 来源: 题型:
某探究小组用HNO3与大理石反应过程中质量减小的方法,研究影响反应速率的因素。所用HNO3浓度为1.00 mL/L、2.00 mol/L,大理石有细颗粒和粗颗粒两种规格,实验温度为25℃、35℃,每次实验HNO3的用量为25.00 mL,大理石用量为10.00 g。
(1)请完成以下实验设计表,并在实验目的一栏中填空:
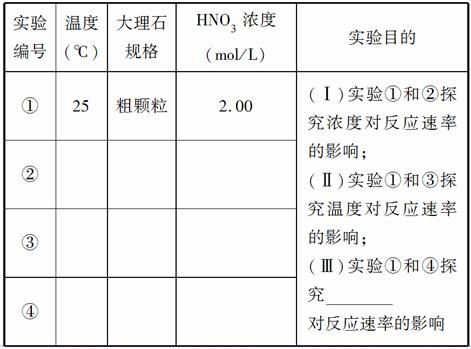
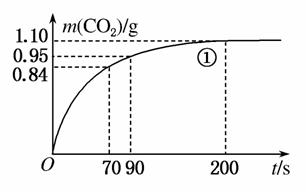
(2)实验①中CO2质量随时间变化的关系见右图。计算实验①中70~90 s范围内用HNO3表示的平均反应速率________(忽略溶液体积变化,不需要写出计算过程)。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列热化学方程式中ΔH代表燃烧热的是( )
A.CH4(g)+3/2O2(g)===2H2O(l)+CO(g) ΔH1
B.S(s)+3/2O2(g)===SO3(g) ΔH2
C.C6H12O6(s)+6O2(g)===6CO2(g)+6H2O(l) ΔH3
D.2CO(g)+O2(g)===2CO2(g) ΔH4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com