
| A. | 负极反应为:14H2O+7O2+28e-=28OH- | |
| B. | 放电一段时间后,负极周围的pH升高 | |
| C. | 放电过程中OH-向正极移动 | |
| D. | 每消耗1mol C2H6,则电路上转移的电子为14mol |
分析 由电池总反应2C2H6+7O2+8KOH=4K2CO3+10H2O可知,原电池工作时C2H6被氧化生成K2CO3,应为原电池的负极,电极反应式为C2H6+18OH--14e-=2CO32-+12H2O,O2得电子被还原,应为原电池正极,电极反应式为2H2O+O2+4e-=4OH-,结合电极反应式解答该题.
解答 解:A.负极发生氧化反应,应为C2H6+18OH--14e-=2CO32-+12H2O,故A错误;
B.由负极电极方程式可知,负极消耗OH-离子,负极周围的pH值减小,故B错误;
C.电池工作过程中,放电过程中OH-向负极移动,故C错误;
D.负极电极反应式为C2H6+18OH--14e-=2CO32-+12H2O,由电极方程式可知每消耗1molC2H6,则电路上转移的电子为14mol,故D正确;
故选D.
点评 本题考查原电池知识,题目难度中等,注意电极反应式的书写和电解质溶液的酸碱性变化,正确书写电极方程式为解答该题的关键,做题时注意体会.


 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
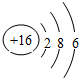 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+、Cl-、Fe3+、CO32- | B. | H+、Cl-、ClO-、Ca2+ | ||
| C. | Mg2+、Cl-、NO3-、K+ | D. | K+、ClO-、NO3-、Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
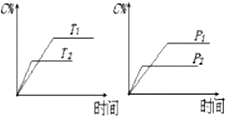
| A. | 达平衡后,加入催化剂则C%增大 | B. | 达平衡后,若升温,平衡左移 | ||
| C. | 化学方程式中n>c+d | D. | 达平衡后,增加A的量平衡向右移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| C | ||
| A | R | B |
| D |
| A. | 4 Z | B. | 4 Z+10 | C. | 4 Z+5 | D. | 4 Z+14 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
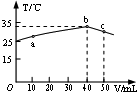
| A. | HA溶液的物质的量浓度为0.01mol/L | |
| B. | a→b的过程中,混合溶液中可能存在:c(A-)=c(Na+) | |
| C. | b→c的过程中,温度降低的主要原因是溶液中A-发生了水解反应 | |
| D. | 25℃时,HA的电离平衡常数K约为1.25×10-3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ba2+(aq)+SO42-(aq)=BaSO4(s)△H=-2.92kJ/mol | |
| B. | Ba2+(aq)+SO42-(aq)=BaSO4(s)△H=-0.72kJ/mol | |
| C. | Ba2+(aq)+SO42-(aq)=BaSO4(s)△H=-18kJ/mol | |
| D. | Ba2+(aq)+SO42-(aq)=BaSO4(s)△H=-73kJ/mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com