
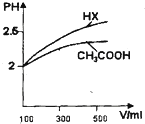
 已知25℃时部分弱电解质的电离平衡常数数据如下表
已知25℃时部分弱电解质的电离平衡常数数据如下表| 化学式 | 电离常数(25℃) |
| HCN | K=4.9×10-10 |
| CH3COOH | K=1.8×10-5 |
| H2CO3 | Ka1=4.3×10-7、Ka2=5.6×10-11 |
| H2SO3 | Ka1=1.0×10-2、Ka2=1.02×10-7 |
| c(H2SO3) |
| c(HSO3-) |
| c(H2SO3) |
| c(HSO3-) |
| c(H+)c(HSO3-) |
| c(H2SO3) |
| c(H2SO3) | ||
c(HS
|


科目:高中化学 来源: 题型:
 (Ⅰ)2SO2(g)+O2(g)?2SO3(g)反应过程的能量变化如图所示.请回答下列问题:
(Ⅰ)2SO2(g)+O2(g)?2SO3(g)反应过程的能量变化如图所示.请回答下列问题:| 7 |
| 10 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ⑥ | ⑩ | ||||||
| 3 | ① | ③ | ⑤ | ⑦ | ⑧ | ⑨ | ||
| 4 | ② | ④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验编号 | 待测血液的体积/mL | 滴入KMnO4溶液的体积/mL |
| 1 | 20.00 | 11.95 |
| 2 | 20.00 | 13.00 |
| 3 | 20.00 | 12.05 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
125 53 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、新制氯水中只有Cl2和H2O分子 |
| B、氯气跟水反应生成两种强酸 |
| C、光照氯水时有气体逸出,该气体是Cl2 |
| D、新制氯水放置数天后酸性会变强 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com