
【题目】研究催化剂对化学反应有重要意义。为探究催化剂对双氧水分解的催化效果,某研究小组做了如下实验:

(1)甲同学欲用上图所示实验来证明MnO2是H2O2分解反应的催化剂。该实验________(填“能”或“不能”)达到目的,原因是___________。
(2)为探究MnO2的量对催化效果的影响,乙同学分别量取50mL 1%H2O2加入容器中,在一定质量范围内,加入不同质量的MnO2,测量所得气体体积,数据如下:
MnO2的质量/g | 0.1 | 0.2 | 0.4 |
40s末O2体积 | 49 | 61 | 86 |
由此得出的结论是______________。
(3)为分析Fe3+和Cu2+对H2O2分解反应的催化效果,丙同学设计如下实验(三支试管中均盛有![]() )
)
试管 | I | II | III |
滴加试剂 | 5滴 | 5滴 | 5滴 0.3 |
产生气泡情况 | 较快产生细小气泡 | 缓慢产生细小气泡 | 无气泡产生 |
结论是___________,实验III的目的是___________。
(4)查阅资料得知:将作为催化剂的![]() 溶液加入
溶液加入![]() 溶液后,溶液中会发生两个氧化还原反应,且两个反应中
溶液后,溶液中会发生两个氧化还原反应,且两个反应中![]() 均参加了反应,试从催化剂的角度分析,这两个氧化还原反应的化学方程式分别是_________________和_________________(按反应发生的顺序写)。
均参加了反应,试从催化剂的角度分析,这两个氧化还原反应的化学方程式分别是_________________和_________________(按反应发生的顺序写)。
【答案】不能 因为没有确认![]() 的质量和化学性质是否改变 在一定质量范围内,
的质量和化学性质是否改变 在一定质量范围内,![]() 质量越大,反应速率越快
质量越大,反应速率越快 ![]() 和
和![]() 对
对![]() 的分解均有催化作用,且
的分解均有催化作用,且![]() 比
比![]() 催化效果好 做对比实验,证明
催化效果好 做对比实验,证明![]() 对
对![]() 的分解没有催化作用
的分解没有催化作用 ![]()
![]()
【解析】
(1)该实验中没有确认![]() 的质量和化学性质是否改变,所以不能确定二氧化锰其催化剂作用;
的质量和化学性质是否改变,所以不能确定二氧化锰其催化剂作用;
(2).从表中数据分析,二氧化锰的质量越大,反应速率越快,所以说明在一定质量范围内,![]() 质量越大,反应速率越快;
质量越大,反应速率越快;
(3)实验中加入的铁离子和铜离子对实验有影响,且 ![]() 和
和![]() 对
对![]() 的分解均有催化作用,且
的分解均有催化作用,且![]() 比
比![]() 催化效果好;实验III的目的是做对比实验,证明
催化效果好;实验III的目的是做对比实验,证明![]() 对
对![]() 的分解没有催化作用;
的分解没有催化作用;
(4) 氯化铁中的铁离子具有氧化性,所以和过氧化氢反应中氯化铁做氧化剂,过氧化氢做还原剂,生成氧气和氯化亚铁,下一个反应中氯化亚铁做还原剂,过氧化氢做氧化剂生成水,反应的方程式为:2FeCl3+H2O2=2FeCl2+O2↑+2HCl、2FeCl2+H2O2+2HCl =2FeCl3+2H2O。


科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.CO2通过Na2O2使其增重a g时,反应中转移的电子数为a/28NA
B.60gSi02中含Si—O键的个数为2NA
C.10g49%的硫酸与10g49%的H3PO4溶液中所含的氧原子数均为0.2NA
D.CO和N2为等电子体,22.4L的CO气体与lmol N2所含的电子数相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)甲醇(CH3OH)是重要的溶剂和替代燃料,工业上用CO和H2在一定条件下制备CH3OH的反应为:CO(g)+2H2(g)= CH3OH(g),在体积为1L的恒容密闭容器中,充入2 molCO和4molH2,一定条件下发生上述反应,测得CO(g)和CH3OH(g)的浓度随时间变化如图所示。
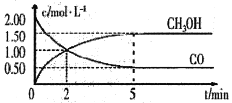
①从反应开始至达到平衡,用氢气表示的平均反应速率υ(H2)=_______mol/(L·min)
②下列说法正确的是______(填字母序号)。
A.达到平衡时,CO的转化率为75%
B.5min后容器中混合气体的平均相对分子质量不再改变
C.达到平衡后,再充入氩气,反应速率减小
D.2min前υ(正)>υ(逆),2min后υ(正)<υ(逆)
③该条件下反应的平衡常数K=______。
(2)已知:I.CO的燃烧热为△H=-283.0kJ·mol-1
II.H2O(1)=H2O (g) △H=+44.0 kJ·mol-1
III.2CH3OH(g)+CO2(g)![]() CH3OCOOCH3(g)+ H2O(g) △H=-15.5 kJ·mol-1
CH3OCOOCH3(g)+ H2O(g) △H=-15.5 kJ·mol-1
则①2CH3OH(g)+CO(g)+![]() O2(g)
O2(g)![]() CH3OCOOCH3(g)+ H2O( l) △H=_____。
CH3OCOOCH3(g)+ H2O( l) △H=_____。
②对于可逆反应2CH3OH(g)+CO(g)+ ![]() O2(g)
O2(g)![]() CH3 OCOOCH3(g)+H2O(1)采取以下措施可以提高CH3OCOOCH3产率的是____(填字母)
CH3 OCOOCH3(g)+H2O(1)采取以下措施可以提高CH3OCOOCH3产率的是____(填字母)
A.降低体系的温度 B.压缩容器的体积
C.减少水量 D.选用适当的催化剂
(3)比亚迪双模电动汽车使用高铁电池供电。高铁电池的总反应为:3Zn(OH)+2Fe(OH)3+4KOH![]() 3Zn+2K2 FeO4+8H2O,则充电时的阳极反应式为_______。
3Zn+2K2 FeO4+8H2O,则充电时的阳极反应式为_______。
(4)若往20mL0.0lmol/L的弱酸HNO2溶液中逐滴加入一定浓度的烧碱溶液,测得混合溶液的温度变化如下图所示,下列有关说法正确的是______(填序号)。
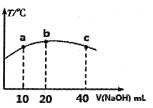
①该烧碱溶液的浓度为0.02mol/L
②该烧碱溶液的浓度为0.01mol/L
③HNO2的电离平衡常数:b点>a点
④从b点到c点,混合溶液中一直存在:c(Na+)>c(NO2-)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值,下列说法正确的是( )
A.1L0.5mol/LNaHCO3溶液中含有的HCO3-数目小于0.5NA
B.标准状况下,![]() 与
与![]() 在光照条件下反应生成HCl分子数为
在光照条件下反应生成HCl分子数为![]()
C.容器中2molNO与1molO2充分反应,产物的分子数为2NA
D.电解精炼铜时阳极减轻32 g,电路中转移电子数目一定为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列反应的热化学方程式:
6C(s)+5H2(g)+3N2(g)+9O2(g)=2C3H5(ONO2)3(l)△H1
2 H2(g)+ O2(g)= 2H2O(g)△H2
C(s)+ O2(g)=CO2(g)△H3
则反应4C3H5(ONO2)3(l)= 12CO2(g)+10H2O(g) + O2(g) +6N2(g)的△H为
A. 12△H3+5△H2-2△H1 B. 2△H1-5△H2-12△H3
C. 12△H3-5△H2-2△H1 D. △H1-5△H2-12△H3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请应用化学反应原理的相关知识解决下列问题:
![]() 已知NaCl的溶解热为
已知NaCl的溶解热为![]() 吸热
吸热![]()
![]()
![]()
![]()
![]()
写出钠在氯气中燃烧的热化学方程式:__________。
![]() 一定条件下,在
一定条件下,在![]() 恒容密闭容器中充入
恒容密闭容器中充入![]() 和
和![]() 发生反应:
发生反应:![]() ,如图所示为反应体系中
,如图所示为反应体系中![]() 的平衡转化率与温度的关系曲线。已知在温度为
的平衡转化率与温度的关系曲线。已知在温度为![]() 的条件下,该反应
的条件下,该反应![]() 达到平衡状态;
达到平衡状态;
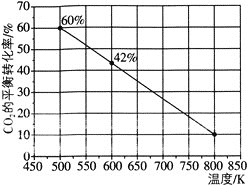
![]() 该反应是________
该反应是________![]() 填“吸热”或“放热”
填“吸热”或“放热”![]() 反应。
反应。
![]() 在
在![]() 时段反应速率
时段反应速率![]() 为_________。
为_________。
![]() 若改充入
若改充入![]() 和
和![]() ,图中的曲线会_________
,图中的曲线会_________![]() 填“
填“![]() 。
。
![]() 根据下表数据回答问题:
根据下表数据回答问题:
表1 ![]() 时浓度为
时浓度为![]() 两种溶液的pH
两种溶液的pH
溶质 | NaClO |
|
pH |
|
|
表2 ![]() 时两种酸的电离平衡常数
时两种酸的电离平衡常数
|
| |
|
|
|
|
|
|
![]() 根据表1能不能判断出
根据表1能不能判断出![]() 与HClO酸性强弱?_____________
与HClO酸性强弱?_____________![]() 填“能”或“不能”
填“能”或“不能”![]() 。
。
![]() 溶液中离子浓度由大到小的顺序为__________。
溶液中离子浓度由大到小的顺序为__________。
![]() 溶液和
溶液和![]() 溶液反应的离子方程式为________。
溶液反应的离子方程式为________。
![]() 已知:
已知:![]() 时,
时,![]() 、
、![]() ;AgCl为白色沉淀,
;AgCl为白色沉淀,![]() 为砖红色沉淀。
为砖红色沉淀。![]() 时,向
时,向![]() 和
和![]() 浓度均为
浓度均为![]() 的混合溶液中逐滴加入
的混合溶液中逐滴加入![]() 溶液至过量且不断搅拌,实验现象为__________。
溶液至过量且不断搅拌,实验现象为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知C—C键可以绕键轴自由旋转,结构简式如下的烃,下列说法中正确的是( )
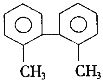
A.分子中至少有8个碳原子处于同一平面上
B.分子中至少有9个碳原子处于同一平面上
C.该烃的一氯取代物最多有8种
D.该烃是苯的同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学课外小组用下图装置制取溴苯。先向分液漏斗中加入苯和液溴,再将混合液慢慢滴入反应器A(A下端活塞关闭)中。
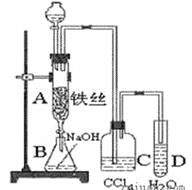
(1)写出A中反应的化学方程式______________________。
(2)实验结束时,打开A下端的活塞,让反应液流入B中,充分振荡,目的是________________,写出有关的化学方程式__________________________________________________。
(3)C中盛放CCl4的作用是__________________。
(4)能证明苯和液溴发生的是取代反应,而不是加成反应,可向试管D中加入AgNO3溶液,若产生淡黄色沉淀,则能证明。另一种验证的方法是向试管D中加入________,现象是______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com