
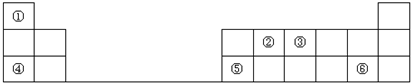
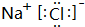
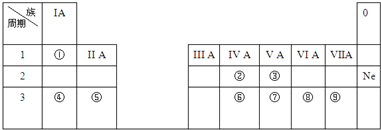
分析 由元素在周期表中的位置可知,①为H、②为C、③为N、④为Na、⑤为Al、⑥为Cl.
(1)钠与水反应生成氢氧化钠与氢气;
(2)同周期自左而右金属性减弱;
(3)元素③的最高价氧化物对应的水化物为硝酸;
(4)氨气与氯化氢生成NH4Cl固体;
(5)④与⑥两元素组成的化合物为NaCl,由钠离子与氯离子构成;
(6)④、⑤的氧化物的水化物分别为氢氧化钠、氢氧化铝,二者反应生成偏铝酸钠与水.
解答 解:由元素在周期表中的位置可知,①为H、②为C、③为N、④为Na、⑤为Al、⑥为Cl.
(1)②的元素名称为碳,钠与水反应生成氢氧化钠与氢气,反应方程式为2Na+2H2O=2NaOH+H2↑,故答案为:碳;2Na+2H2O=2NaOH+H2↑;
(2)同周期自左而右金属性减弱,故金属性最强为Na,故答案为:Na;
(3)元素③的最高价氧化物对应的水化物为硝酸,化学式为HNO3,故答案为:HNO3;
(4)氨气与氯化氢生成NH4Cl固体,反应方程式为:NH3+HCl=NH4Cl,故答案为:NH3+HCl=NH4Cl;
(5)④与⑥两元素组成的化合物为NaCl,由钠离子与氯离子构成,电子式为: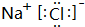 ,故答案为:
,故答案为: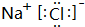 ;
;
(6)④、⑤的氧化物的水化物分别为氢氧化钠、氢氧化铝,二者反应生成偏铝酸钠与水,故答案为:能.
点评 本题考查元素周期表与元素周期律综合运用,题目基础性、贴近教材,熟练掌握元素周期律表的结构.


 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案科目:高中化学 来源: 题型:填空题
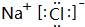 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 食品保存在冰箱中不易坏,说明温度对反应速率有影响 | |
| B. | 在金属与非金属的分界线附近寻找半导体材料 | |
| C. | 在周期表中,第IA族全部为金属元素 | |
| D. | 金刚石与石墨互为同素异形体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知A、B、C、D、E、F都是元素周期表中前四周期的元素,它们的核电荷数依次递增.B原子的P轨道半充满,形成氢化物的沸点是同主族元素的氢化物中最低的.D原子得到一个电子后3P轨道全充满.A+比D原子形成的离子少一个电子层.C与A形成A2C型离子化合物.E的原子序数为31,F与B属同一主族,E与F形成的化合物常用于制造半导体.根据以上信息,回答下列问题:
已知A、B、C、D、E、F都是元素周期表中前四周期的元素,它们的核电荷数依次递增.B原子的P轨道半充满,形成氢化物的沸点是同主族元素的氢化物中最低的.D原子得到一个电子后3P轨道全充满.A+比D原子形成的离子少一个电子层.C与A形成A2C型离子化合物.E的原子序数为31,F与B属同一主族,E与F形成的化合物常用于制造半导体.根据以上信息,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等于90% | B. | 大于90% | C. | 小于90% | D. | 无法判断 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com