

分析 (1)根据核外电子数及电子排布分析;
(2)根据氧化铁和氧化锰不溶于水,钨酸钠易溶于水判断A为钨酸钠,则MnWO4与NaOH反应生成二氧化锰和钨酸钠;
(3)把氧化铁转化为三价铁离子的溶液,再用硫氰化钾检验;
(4)Na2WO4与浓盐酸反应生成氯化钠和H2WO4;H2WO4易分解为氧化钨和水;
(5)高温条件下,铝与氧化钨反应生成单质钨和氧化铝,根据原子守恒书写;在铝热剂上加少量KClO3,插上镁条并将其点燃;
(6)根据Ksp(FeWO4)=c(Fe2+)•c(WO42-)=2.5×10-12,结合亚铁离子的浓度计算即可.
解答 解:(1)74W的质子数可知电子数为74,核外各电子层电子数为2、8、18、32、14、2,电子层数等于周期序数,所以在周期表的位置是第六周期,
故答案为:六;
(2)氧化铁和氧化锰不溶于水,钨酸钠易溶于水判断A为钨酸钠,则MnWO4与NaOH反应生成二氧化锰和钨酸钠,反应中锰元素化合价升高作还原剂,氧气作氧化剂,其反应方程式为:2MnWO4+4NaOH+O2$\frac{\underline{\;熔融\;}}{\;}$2Na2WO4+2MnO2+2H2O,
故答案为:2MnWO4+4NaOH+O2$\frac{\underline{\;熔融\;}}{\;}$2Na2WO4+2MnO2+2H2O;
(3)实验室检验滤渣中含有Fe2O3的方法是:把氧化铁转化为三价铁离子的溶液,再用硫氰化钾检验,即取少量滤渣于试管中,加适量稀盐酸溶解.取少量上层清液,滴加硫氰化钾溶液,若溶液变红即含有Fe2O3;
故答案为:取少量滤渣于试管中,加适量稀盐酸溶解.取少量上层清液,滴加硫氰化钾溶液,若溶液变红即含有Fe2O3;
(4)Na2WO4与浓盐酸反应生成氯化钠和H2WO4,离子方程式为:WO42-+2H+═H2WO4↓,H2WO4易分解为氧化钨和水,属于分解反应,
故答案为:H2WO4;分解反应;
(5)高温条件下,铝与氧化钨反应生成单质钨和氧化铝,其反应方程式为:WO3+2Al$\frac{\underline{\;通电\;}}{\;}$W+Al2O3,实验室引发铝热反应的操作方法是:在混合物上面加少量氯酸钾固体,中间插一根用砂纸打磨过的镁带,用燃着的小木条点燃镁带;
故答案为:WO3+2Al$\frac{\underline{\;通电\;}}{\;}$W+Al2O3;在混合物上面加少量氯酸钾固体,中间插一根用砂纸打磨过的镁带,用燃着的小木条点燃镁带;
(6)根据Ksp(FeWO4)=c(Fe2+)•c(WO42-)=2.5×10-12,Ksp(MnWO4)=7.5×10-16,体积为1L含MnWO4物质的量为0.6mol,c(Fe2+)=$\frac{Ksp}{c(WO{\;}_{4}{\;}^{2-})}$,解得c(Fe2+)=2000mol/L,这种浓度的溶液无法配置,
故答案为:2000;不能.
点评 本题主要考查工业制备流程、金属的冶炼、氧化还原反应和化学计算,并考查学生正确书写化学方程式的能力,一道综合知识的考查题,考查学生分析和解决问题的能力,综合性强,难度中等.


 应用题作业本系列答案
应用题作业本系列答案科目:高中化学 来源: 题型:实验题
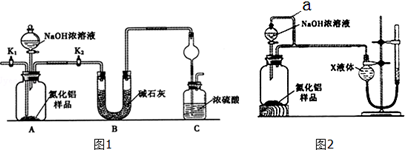
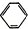

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
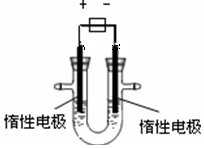
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

| 物质 | 熔点/℃ | 沸点/℃ | 其他 |
| CCl4 | -23 | 76 | 与TiCl4互溶 |
| TiCl4 | -25 | 136 | 遇潮湿空气产生白雾 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
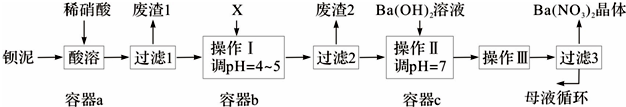
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
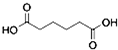 是一种工业上具有重要意义的有机二元酸,在化工生产、有机合成工业、医药、润滑剂制造等方面都有重要作用,能够发生成盐反应、酯化反应等,并能与二元醇缩聚成高分子聚合物等,己二酸产量居所有二元羧酸中的第二位.实验室合成己二酸的反应原理和实验装置示意图如图:
是一种工业上具有重要意义的有机二元酸,在化工生产、有机合成工业、医药、润滑剂制造等方面都有重要作用,能够发生成盐反应、酯化反应等,并能与二元醇缩聚成高分子聚合物等,己二酸产量居所有二元羧酸中的第二位.实验室合成己二酸的反应原理和实验装置示意图如图: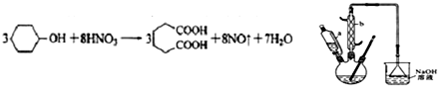
| 物质 | 密度(20℃) | 熔点 | 沸点 | 溶解性 | 相对分子质量 |
| 环己醇 | 0.962g/cm3 | 25.9℃ | 160.8℃ | 20℃时水中溶解度3.6g,可混溶于乙醇、苯 | 100 |
| 乙二酸 | 1.36g/cm3 | 152℃ | 337.5℃ | 在水中的溶解度:15℃时,1.44g,25℃时2.3g,易溶于乙醇,不溶于苯 | 146 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com