
| A. | -44.2kJ•mol-1 | B. | +44.2kJ•mol-1 | C. | -330kJ•mol-1 | D. | +330kJ•mol-1 |
分析 已知H2(g)、C2H4(g)和C2H5OH(l)的燃烧热分别是-285.8kJ/mol、-1411.0kJ/mol和-1366.8kJ/mol,则:①H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-285.8kJ/mol;
②C2H4(g)+3O2(g)=2H2O(l)+2CO2(g)△H=-1411.0kJ/mol,③C2H5OH(l)+3O2(g)=3H2O(l)+2CO2 (g)△H=-1366.8kJ/mol,根据盖斯定律 ②-③可得C2H4(g)+H2O(l)=C2H5OH(l),反应热也进行相应的计算.
解答 解:已知H2(g)、C2H4(g)和C2H5OH(l)的燃烧热分别是-285.8kJ/mol、-1411.0kJ/mol和-1366.8kJ/mol,则三者的热化学方程式分别为:
①H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-285.8kJ/mol,
②C2H4(g)+3O2(g)=2H2O(l)+2CO2(g)△H=-1411.0kJ/mol,
③C2H5OH(l)+3O2(g)=3H2O(l)+2CO2 (g)△H=-1366.8kJ/mol,
根据盖斯定律 ②-③可得:C2H4(g)+H2O(l)=C2H5OH(l)△H=(-1411.0kJ/mol)-(-1366.8kJ/mol)=-44.2kJ/mol,
故选A.
点评 本题考查反应热的计算、盖斯定律的应用,题目难度中等,注意掌握盖斯定律的含义及在反应热计算中的应用,明确热化学方程式的书写原则,试题培养了学生的分析能力及化学计算能力.


科目:高中化学 来源: 题型:实验题
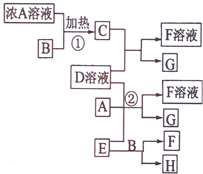 有关物质存在如图所示的转化关系(部分产物已省略).通常C为气体单质,G为紫黑色固体单质,且受热易升华.实验室中,常用固体E在B的催化下加热制取气体单质H,H能使带火星的木条复燃.
有关物质存在如图所示的转化关系(部分产物已省略).通常C为气体单质,G为紫黑色固体单质,且受热易升华.实验室中,常用固体E在B的催化下加热制取气体单质H,H能使带火星的木条复燃.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况8.4LCH4 | B. | 0.3molHCl | C. | 98gH3PO4 | D. | 18gH2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钡可以从氯化钾溶液中置换出钾 | |
| B. | 钡可以从冷水中置换出氢而得到氢气 | |
| C. | 钡可以从氯化钠溶液中置换出钠 | |
| D. | 钡不能置换出金属钠 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 简单氢化物的沸点:Z>W | |
| B. | 由W、Y两种元素形成的化合物一定不含共价键 | |
| C. | 简单气态氢化物的热稳定性:X>W | |
| D. | 元素Y和Z的简单离子具有相同的电子层结构 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2N2H4(g)+N2O4(g)═3N2(g)+4H2O(g)△H=-542.7 kJ•mol-1 | |
| B. | 2N2H4(g)+N2O4(g)═3N2(g)+4H2O(g)△H=-1 059.3 kJ•mol-1 | |
| C. | N2H4(g)+$\frac{1}{2}$N2O4(g)═$\frac{3}{2}$N2(g)+2H2O(g)△H=-1 076.7 kJ•mol-1 | |
| D. | 2N2H4(g)+N2O4(g)═3N2(g)+4H2O(g)△H=-1 076.7 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原溶液中Fe2+和Fe3+至少有一种,一定没有SiO32-、Ag+ | |
| B. | 步骤Ⅱ中无色气体可能含有CO2,原溶液中可能含有CO32- | |
| C. | 原溶液中肯定含有Cl-、Mg2+ | |
| D. | 为确定是否含有Cl-,可取原溶液加入少量硝酸银和稀硝酸,观察是否产生沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 质量数为18的氧核素:${\;}_8^{18}$O | B. | 锂离子的结构示意图: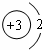 | ||
| C. | 硝基苯的结构简式: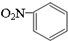 | D. | 四氯化碳的电子式: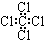 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com