
【题目】设NA表示阿伏加德罗常数的数值,下列叙述正确的是( )
A.物质的量浓度为0.5 mol·L-1 (NH4)2SO4溶液中,含有NH4+个数小于NA
B.1mol羟基中电子数为10NA
C.3.9gNa2O2晶体中阴阳离子总数为0.2NA
D.含4molHCl的浓盐酸和足量MnO2加热反应可生成Cl2分子少于NA个
科目:高中化学 来源: 题型:
【题目】下列由实验得出的结论正确的是
实验 | 结论 | |
A. | 将乙烯通入溴的四氧化碳溶液,溶液最终变为无色透明 | 生成的1,2—二溴乙烷无色、可溶于四氧化碳 |
B. | 乙醇和水都可与金属钠反应产生可燃性气体 | 乙醇分子中的氢与水分子中的氢具有相同的活性 |
C. | 用乙酸浸泡水壶中的水垢,可将其清除 | 乙酸的酸性小于碳酸的酸性 |
D. | 甲烷与氯气在光源下反应后的混合气体能使湿润的石蕊试纸变红 | 生成的氯甲烷具有酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在电解水制取H2和O2时,为了增强导电性,常常要加入一些电解质,下列物质可选用( )
A. NaCl B. HC1 C. NaOH D. CuSO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学在生产、生活中有着广泛的应用,下列物质的化学性质与应用的对应关系正确的是
化学性质 | 应用 | |
A | 0价铁具有还原性 | 铁粉可用于食品中的脱氧剂 |
B | 明矾与NaOH生成Al(OH)3 | 明矾可作净水剂 |
C | Fe的金属性比Cu活泼 | FeCl3浓溶液腐蚀Cu刻制印刷电路板 |
D | NaHCO3水解显碱性 | 发酵粉中含有NaHCO3 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究测定中和热的实验,小明利用50 mL 0.50 mol·L-1盐酸与50 mL 0.55 mol·L-1NaOH溶液,在如图所示的装置中进行中和反应,并通过测定反应过程中所放出的热量来计算中和热(中和热数值为57.3 kJ/mol)。
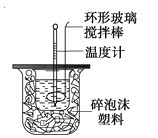
(1)写出实验所进行的中和反应的热化学方程式 。
(2)实验装置中,烧杯间填满碎纸条的作用为 。
(3)该实验中,使用浓度略大于盐酸的NaOH溶液的原因是 ,若改用60 mL 0.50 mol·L-1盐酸跟50 mL 0.55 mol·L-1,NaOH溶液进行反应,所求中和热的数值_________(填“相等”或“不相等”),理由是 。
(4)小明利用上述装置做实验,测得中和热的数值偏低,请你分析可能的原因是 。
A.测量盐酸的温度后,温度计没有用水冲洗干净
B.做本实验的当天室温较高
C.将量筒中的NaOH(aq)倒入小烧杯时动作迟缓
D.在量取盐酸时仰视读数
E.大烧杯的盖板中间小孔太大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把500mLNH4HCO3和Na2CO3的混合溶液分成五等份,取一份加入含amol氢氧化钠的溶液加热,恰好使NH![]() 完全转化为NH3逸出,另取一份加入含bmolHCl的盐酸恰好反应完全,则该混合溶液中c(Na+)为
完全转化为NH3逸出,另取一份加入含bmolHCl的盐酸恰好反应完全,则该混合溶液中c(Na+)为
A. (2b-a) mol/L B.(10b-5a) mol/L
C. ![]() mol/L D.
mol/L D.![]() mol/L
mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E是中学化学常见单质, X、Y、Z、M、N、W、H、K是常见化合物,X是B和C的化合产物,它们之间有如下转化关系(反应物和产物中的H2O已略去):
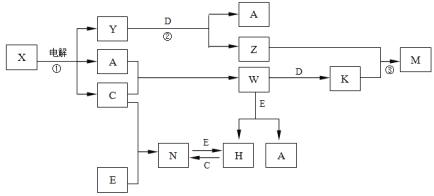
(1)Y的电子式为 ,构成E单质的元素在周期表中位于______________。
(2)反应①的离子方程式为______________
反应③的离子方程式为______________
(3)某工厂用C制漂白粉。
①写出制漂白粉的化学方程式______________
②为测定该工厂制得的漂白粉中有效成分的含量,某小组进行了如下实验:称取漂白粉2.0g,研磨后溶解,配制成250mL溶液,取出25.00mL加入到锥形瓶中,再加入过量的KI溶液和过量的硫酸,此时发生的离子方程式为: ,静置。待完全反应后,用0.1mol·L-1的Na2S2O3溶液做标准溶液滴定反应生成的碘,已知反应式为:2Na2S2O3+I2=Na2S4O6+2NaI,共用去Na2S2O3溶液20.00mL。则该漂白粉中有效成分的质量分数为 (保留到小数点后两位)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com