
| m |
| M |
| 9.6微米红外激光 |
| 9.6微米红外激光 |
| 5.6g |
| 56g/mol |
| 9.72g |
| 81g/mol |
|


科目:高中化学 来源: 题型:
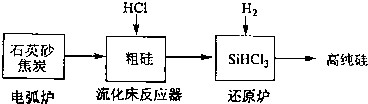
| 发生的主要反应 | |||||
| 电弧炉 | SiO2+2C
| ||||
| 流化床反器 | Si+3HCl
| ||||
| 还原炉 | SiHCl3+H2
|
| 物质 | Si | SiCl4 | SiHCl3 | SiH2Cl2 | SiH3Cl | HCl | SiH4 |
| 沸点/℃ | 2355 | 57.6 | 31.8 | 8.2 | -30.4 | -84.9 | -111.9 |
查看答案和解析>>
科目:高中化学 来源: 题型:
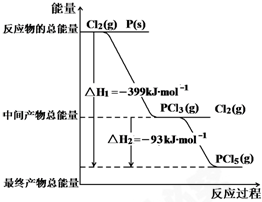 红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g).反应过程和能量关系如图所示( 图中的△H表示生成1mol产物的数据).根据图示,回答下列问题:
红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g).反应过程和能量关系如图所示( 图中的△H表示生成1mol产物的数据).根据图示,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
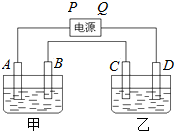 已知A、B、C、D都是铂电极,P、Q是直流电源的两极,通电后发现B极质量增加.
已知A、B、C、D都是铂电极,P、Q是直流电源的两极,通电后发现B极质量增加.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
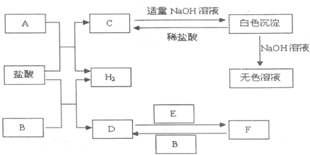 下列物质A~F是我们熟悉的单质或化合物,其中A、E均为C中元素形成的单质,B是常见的金属,且B的合金用量最大;在适当的条件下,它们之间可以发生如图所示的转化.
下列物质A~F是我们熟悉的单质或化合物,其中A、E均为C中元素形成的单质,B是常见的金属,且B的合金用量最大;在适当的条件下,它们之间可以发生如图所示的转化.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、质量守恒、电子守恒、电荷守恒 |
| B、电子守恒、质量守恒、电荷守恒 |
| C、电子守恒、电荷守恒、质量守恒 |
| D、电荷守恒、质量守恒、电子守恒 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、32g O2气体含有的氧原子数为NA |
| B、2L 0.3mol/L Na2SO4溶液中含有Na+为0.6NA |
| C、27g铝完全反应后失去的电子数为3NA |
| D、11.2L氮气所含的分子数为0.5NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com