(2010?丰台区一模)为探究铁与浓硫酸在加热条件下的反应,某活动小组设计并完成以下实验:

(1)实验目的:分析铁与浓硫酸在加热条件下的反应.
①洗气瓶中浓硫酸的作用是
干燥
干燥
.
②写出加热条件下铁与浓硫酸反应生成SO
2的化学方程式
2Fe+6H
2SO
4(浓)
Fe
2(SO
4)
3+3SO
2↑+6H
2O
2Fe+6H
2SO
4(浓)
Fe
2(SO
4)
3+3SO
2↑+6H
2O
.
活动小组预测随着反应的进行,硫酸的浓度降低,可能还会有氢气产生,为进一步确认气体的成分还需要进行进一步的实验.
(2)实验目的:检验气体的成分.
试剂:氢氧化钠溶液、浓硫酸、氧化铜粉末、无水硫酸铜固体、品红溶液、高锰酸钾酸性溶液、碱石灰.
仪器如下图(可重复使用,可根据需要取用);
①连接仪器.将装置的字母填入□内,并将试剂名称填写在相应的括号内(可不填满)
②若混合气体中含有氢气,实验过程中能观察到的现象是
D中固体粉末由黑色变为红色,E中固体由白色变为蓝色
D中固体粉末由黑色变为红色,E中固体由白色变为蓝色
.
(3)实验目的:确定产物的含量.
①若混合气体中含有SO
2和H
2,为测定混合气体中各成分含量,需收集的数据有
混合气体的总体积;反应前后D中粉末质量的差值(反应前D中氧化铜粉末质量反应后D中粉末的质量)
混合气体的总体积;反应前后D中粉末质量的差值(反应前D中氧化铜粉末质量反应后D中粉末的质量)
.
②若反应后烧瓶中溶液含有的金属阳离子有Fe
2+、Fe
3+,其中检验是否含有Fe
3+可采用的试剂为
KSCN溶液
KSCN溶液
;如果该过程中共消耗了11.2g铁,反应后的溶液能吸收标准状况下1.12L氯气,则原溶液中含有Fe
3+的物质的量为
0.1
0.1
mol.

 (2010?丰台区一模)X、Y、Z、W有如图所示的转化关系,则X、Y可能是①C、CO②S、SO2③AlCl3、Al(OH)3
(2010?丰台区一模)X、Y、Z、W有如图所示的转化关系,则X、Y可能是①C、CO②S、SO2③AlCl3、Al(OH)3

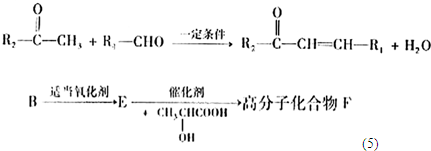
 +
+
 +H2O
+H2O +
+
 +H2O
+H2O

 +n
+n
 +(2n-1)H2O
+(2n-1)H2O +n
+n
 +(2n-1)H2O
+(2n-1)H2O +n
+n
 +(2n-1)H2O
+(2n-1)H2O +n
+n
 +(2n-1)H2O
+(2n-1)H2O (2010?丰台区一模)[化学与技术]工业上可以利用氟硅酸、碳酸氢铵制备冰晶石(Na3AlF6),其工艺如下:
(2010?丰台区一模)[化学与技术]工业上可以利用氟硅酸、碳酸氢铵制备冰晶石(Na3AlF6),其工艺如下:
 NH3?H2O+H+、HCO3-+H2O
NH3?H2O+H+、HCO3-+H2O H2CO3+OH-
H2CO3+OH- NH3?H2O+H+、HCO3-+H2O
NH3?H2O+H+、HCO3-+H2O H2CO3+OH-
H2CO3+OH-