
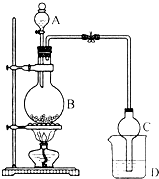
 某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、无水醋酸钠,D中放有饱和碳酸钠溶液.已知:
某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、无水醋酸钠,D中放有饱和碳酸钠溶液.已知:| 试剂 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
| 沸点(℃) | 34.7 | 78.5 | 118 | 77.1 |
 CH3CO18OCH2CH3+H2O.
CH3CO18OCH2CH3+H2O.分析 (1)硫酸与醋酸钠反应生成醋酸,酯化反应为可逆反应,且浓硫酸具有吸水性;酯化反应的本质为酸脱羟基,醇脱氢,乙醇、乙酸反应生成乙酸乙酯和水,且为可逆反应;
(2)球形干燥管中的球形结构可防止液体倒吸;D中有挥发出来的乙酸,能与碳酸钠反应生成二氧化碳;反应结束后D中乙酸乙酯与碳酸钠溶液分层,且乙酸乙酯的密度比水的密度小.
解答 解:(1)硫酸与醋酸钠反应生成醋酸,为酯化反应提供反应物,酯化反应为可逆反应,且浓硫酸具有吸水性,吸收反应生成的水,使平衡正向移动,可知该反应中浓硫酸的作用为与醋酸钠反应生成醋酸,作催化剂、吸水剂;酯化反应的本质为酸脱羟基,醇脱氢,乙酸与乙醇在浓硫酸作用下加热发生酯化反应生成乙酸乙酯和水,该反应方程式为:CH3COOH+CH3CH218OH  CH3CO18OCH2CH3+H2O;
CH3CO18OCH2CH3+H2O;
故答案为:与醋酸钠反应生成醋酸,作催化剂、吸水剂;CH3COOH+CH3CH218OH  CH3CO18OCH2CH3+H2O;
CH3CO18OCH2CH3+H2O;
(2)球形干燥管C的作用是防止倒吸;反应结束后D中有挥发出来的乙酸,能与碳酸钠反应生成二氧化碳,所以会有气泡产生;反应结束后D中乙酸乙酯难溶于水,与碳酸钠溶液分层,且乙酸乙酯的密度比水的密度小;
故答案为:防止倒吸;气泡;溶液分层.
点评 本题考查乙酸乙酯的制备,题目难度中等,注意掌握乙酸乙酯的制取原理及装置选择,明确反应过程中浓硫酸、饱和碳酸钠溶液的作用,试题有利于提高学生的分析、理解能力及化学实验能力.


 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案 名校联盟快乐课堂系列答案
名校联盟快乐课堂系列答案科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
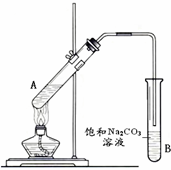 “酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯.回答下列问题:
“酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A是固体,C是气体,正反应吸热 | B. | A是气体,C是气体,正反应放热 | ||
| C. | A是气体,C是固体,正反应放热 | D. | A是气体,C是气体,正反应吸热 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
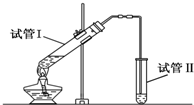 实验室用如图所示装置制备少量乙酸乙 酯.
实验室用如图所示装置制备少量乙酸乙 酯.
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 过滤时,不可将悬浊液从烧杯中直接倒入漏斗中 | |
| B. | 蒸发操作时,应使混合物中的水分完全蒸干后,才能停止加热 | |
| C. | 分液操作时,现将分液漏斗中下层液体从下口放出,再将上层液体从下口放出 | |
| D. | 只要是液体混合物就可以用蒸馏来分离 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入饱和NaCl溶液都产生沉淀 | B. | 加入盐酸先产生沉淀,后沉淀溶解 | ||
| C. | 分散质的粒子都能通过滤纸 | D. | 都能产生丁达尔效应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com