
【题目】下列电离方程式书写不正确的是
A.HNO3=H+ + NO![]() B.Al2(SO4)3=2Al3+ + 3SO
B.Al2(SO4)3=2Al3+ + 3SO![]()
C.Ba(OH)2=Ba2+ + 2OH-D.NaHCO3=Na+ + H+ + CO![]()
科目:高中化学 来源: 题型:
【题目】下列各组物质稀溶液相互反应.无论前者滴入后者,还是后者滴入前者,反应现象相同,且离子方程式也相同的是
A. Ba(HCO3)2溶液与Ba(OH)2溶液 B. NaAlO2溶液与稀硫酸溶液
C. Ca(HCO3)2溶液与NaOH溶液 D. 氨水与硝酸银溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁及其化合物在生产、生活中有广泛应用。
(1)铁原子核外有__________种运动状态不同的电子,Fe3+基态核外电子排布式为_______________。
(2)实验室常用K3[Fe(CN)6]检验Fe2+,[Fe(CN)6]3-中三种元素电负性由大到小的顺序为________(用元素符号表示),CN-中σ键与π键的数目比n(σ)∶n(π)=__________;HCN中C原子轨道的杂化类型为__________。HCN的沸点为25.7℃,既远大于N2的沸点(-195.8℃)也大于HCl的沸点(-85℃)的原因是__________。
(3)FeCl3中的化学键具有明显的共价性,蒸汽状态下以双聚分子(Fe2Cl6)存在,该双聚分子的结构式为________,其中Fe的配位数为_____________。

(4)铁氮化合物(Fe4N)在磁记录材料领域有着广泛的应用前景,其晶胞如上图所示。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,例如图中b位置Fe原子的坐标为(0,![]() ,
,![]() )、(
)、(![]() ,0,
,0,![]() )和(
)和(![]() ,
,![]() ,0),则a位置Fe原子和N原子的坐标分别为__________、__________。N与Fe原子之间最短距离a pm。设阿伏加德罗常数的值为NA,则该铁氮化合物的密度是__________g·cm-3(列出计算表达式)。
,0),则a位置Fe原子和N原子的坐标分别为__________、__________。N与Fe原子之间最短距离a pm。设阿伏加德罗常数的值为NA,则该铁氮化合物的密度是__________g·cm-3(列出计算表达式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图所示。已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差l;Y的单质是一种常见的半导体材料;Z的非金属性在同周期元素中最强.下列说法不正确的是( )
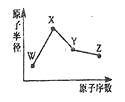
A. 对应简单离子半径:W>X
B. 对应气态氢化物的稳定性:Y<Z
C. 化合物XZW既含离子键,又含极性共价键
D. Z的氢化物和X的最高价氧化物对应水化物的溶液均能与Y的氧化物反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某合金废料主要含铁、铜、铝,为从合金废料中得到Fe2O3、Al2O3和金属Cu等产品,某化学兴趣小组按如下工艺流程进行实验(杂质不与稀硫酸反应)。

请回答下列问题:
(1)固体A主要含有的物质是________。
(2)B到C发生反应的离子方程式为________,溶液C中的阳离子主要有________。
(3)若D为NaOH,则溶液E中铝元素的存在形式是________(填化学式)。
(4)灼烧沉淀F时所用主要仪器之一是________(填序号)。
A.蒸发皿 B.烧杯 C.坩埚 D.试管
(5)氮化铝(AlN)陶瓷是一种具有广阔开发前景的高温结构材料,具有高导热率、高电绝缘性、高强度、高硬度、耐腐蚀等优良性能,工业上可通过Al2O3、碳和N2在高温条件下反应得到,同时生成一种常见气体G,若该反应每转移3.01╳1023个电子,有0.25mol气体G生成,则该反应的化学方程式为_________。在工业上Al2O3的用途还有________(任填一种)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E是元素周期表前四周期中的常见元素,原子序数依次增大,相关信息如下:
元素 | 相关信息 |
A | 基态原子的价电子排布式为nSnnPn |
B | 基态原子中的未成对电子数是同周期中最多的 |
C | 最外层电子数是电子层数的3倍 |
D | 简单离子是第三周期元素中离子半径最小的 |
E | 价电子层中的未成对电子数为4 |
请回答下列问题(用对应元素的元素符号作答):
(1)写出D元素基态原子的价电子排布式_________,E2+价电子的轨道表示式_________________。
(2)这5种元素中电负性最大的元素是_____(填元素符号),A、B、C三种元素的第一电离能由大到小的顺序为_______________(填元素符号)
(3)B、C、D的简单离子的半径由大到小的顺序为_____________(用离子符号表示)
(4)写出C的核外有18个电子的氢化物的电子式_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年,嫦娥四号成功在月球着陆。探测器上的五星红旗由一类特殊的聚酰亚胺(化合物H)制成。以下是H的合成路线:
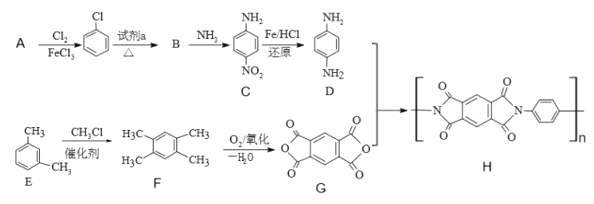
已知: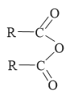 +R’—NH2
+R’—NH2![]() +RCOOH
+RCOOH
(1)A结构简式是____。
(2)试剂a是_____。
(3)B→C的反应类型______;C中含有的官能团名称为_____。
(4)写出D+G→H的化学反应方程式_____。
(5)写出一种苯环上一氯代物有三种,核磁共振氢谱为6:4:2:1:1的F的同分异构体的结构简式_____。(不考虑立体异构)
(6)设计由CH3CH2OH、![]() 合成
合成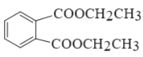 的合成路线_____。(其它物质自选)。
的合成路线_____。(其它物质自选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验过程中对应的变化与右图相符合的是
实验过程 | X | Y |
| |
A | 稀HCl滴加到NaOH溶液中 | V(HCl) | N(Na+) | |
B | 铁粉加入 CuSO4溶液中 | m(Fe) | m(固 体) | |
C | CO2通入NaOH溶液中 | V(CO2) | 溶液的导电能力 | |
D | 稀H2SO4滴加到 Ba(OH)2溶液中 | V(H2SO4) | 溶液的导电能力 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用H2O2、KI和洗洁精可完成“大象牙膏”实验(短时间内产生大量泡沫),某同学依据文献资料对该实验进行探究。
(1)资料1:KI在该反应中的作用:
H2O2+I-=H2O+IO-;H2O2+IO-=H2O+O2↑+I-。总反应的化学方程式是________________。
(2)资料2:H2O2分解反应过程中能量变化如图所示,其中①有KI加入,②无KI加入。下列判断正确的是___________(填字母)。
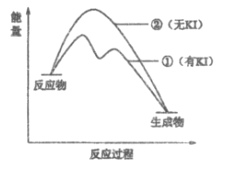
a. 加入KI后改变了反应的路径
b. 加入KI后改变了总反应的能量变化
c. H2O2+I-=H2O+IO-是放热反应
(3)实验中发现,H2O2与KI溶液混合后,产生大量气泡,溶液颜色变黄。再加入CCl4,振荡、静置,气泡明显减少。
资料3:I2也可催化H2O2的分解反应。
①加CCl4并振荡、静置后还可观察到___________,说明有I2生成。
②气泡明显减少的原因可能是:i. H2O2浓度降低;ii. ________。以下对照实验说明i不是主要原因:向H2O2溶液中加入KI溶液,待溶液变黄后,分成两等份于A、B两试管中。A试管加入CCl4,B试管不加CCl4,分别振荡、静置。观察到的现象是_____________。
(4)资料4:I-(aq)+I2(aq)![]() I3-(aq) K=640。
I3-(aq) K=640。
为了探究体系中含碘微粒的存在形式,进行实验:向20 mL一定浓度的H2O2溶液中加入10mL 0.10mol·L-1 KI溶液,达平衡后,相关微粒浓度如下:
微粒 | I- | I2 | I3- |
浓度/(mol·L-1) | 2.5×10-3 | a | 4.0×10-3 |
①a=__________。
②该平衡体系中除了含有I-,I2,I3-外,一定还含有其他含碘微粒,理由是________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com