
分析 (1)根据n=$\frac{V}{{V}_{m}}$、c=$\frac{n}{V}$计算盐酸的物质的量浓度;
(2)根据稀释定律计算;
(3)被氧化的HCl占反应HCl的$\frac{10}{16}$,根据n=$\frac{V}{{V}_{m}}$计算n(Cl2),根据方程式确定消耗HCl的物质的量n(HCl).
解答 解:(1)在标准状况下,28L HCl的物质的量n=$\frac{28L}{22.4L/mol}$=1.25mol,所得盐酸的物质的量浓度c=$\frac{1.25mol}{0.25L}$=5mol/L,
答:所得盐酸的物质的量浓度是5mol/L;
(2)设稀释后盐酸的物质的量浓度为c1,根据稀释定律得5mol/L×0.05L=c1×1L,解得c1=0.25mol/L,
答:稀释后盐酸的物质的量浓度为0.25mol/L;
(3)Cl2在标准状况下的物质的量n(Cl2)=$\frac{0.672L}{22.4L/mol}$=0.03mol,设消耗HCl的物质的量为x,则
2KMnO4+16HCl═2KCl+2MnCl2+5Cl2↑+8H2O
16 5
x 0.03mol
$\frac{16}{5}=\frac{x}{0.03mol}$,解得x=0.096mol,
被氧化的HCl占反应HCl的$\frac{10}{16}$,则被氧化的HCl的物质的量为0.096mol×$\frac{10}{16}$=0.06mol,
答:若产生的Cl2在标准状况下的体积为672mL,则被氧化的HCl的物质的量为0.06mol.
点评 本题考查物质的量浓度计算、稀释定律、化学方程式计算,综合性较强,难度中等,(3)是本题的难点,明确被氧化的HCl占反应HCl的$\frac{10}{16}$是关键.


 优生乐园系列答案
优生乐园系列答案科目:高中化学 来源: 题型:解答题
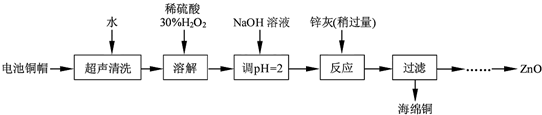
| 开始沉淀的pH | 完全沉淀的pH | |
| Fe3+ | 1.1 | 3.2 |
| Fe2+ | 5.8 | 8.8 |
| Zn2+ | 5.9 | 8.9 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.0mol/L的KNO3溶液:H+、Fe2+、Cl-、SO42- | |
| B. | 甲基橙呈红色的溶液:NH4+、Ba2+、[Al(OH)4]-、Cl- | |
| C. | pH=12的溶液:K+、Na+、CH3COO-、Br- | |
| D. | 与铝反应产生大量氢气的溶液:Na+、K+、CO32-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1molNaCl固体溶于1L水所得溶液中NaCl的物质的量浓度为1mol•L-1 | |
| B. | 2.3g钠转化为钠离子时得到的电子数目为0.1NA | |
| C. | 常温常压下,11.2L 甲烷中所含的氢原子数为2NA | |
| D. | 32g O2和O3混合气体所含的原子数目为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁与盐酸反应:2Fe+6H+═2Fe3++3H2↑ | |
| B. | 大理石和醋酸:CO32-+2H+═H2O+CO2↑ | |
| C. | 铜片插入硝酸银溶液中:Cu+Ag+═Cu2++Ag | |
| D. | 向Ba(OH)2溶液中滴加KHSO4溶液至中性:Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 150mL1mol/L氯化镁溶液 | B. | 450mL1.5 mol/L氯酸钾溶液 | ||
| C. | 50mL1.5 mol/L氯化钾溶液 | D. | 50mL0.5 mol/L氯化铜溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等质量的锌粉和锌片与相同体积、相同浓度的盐酸反应,反应速率相等 | |
| B. | 氢气与氮气能够缓慢地反应生成氨气,使用合适催化剂可以提高化学反应的转化率 | |
| C. | 用铁片与硫酸制备氢气时,滴加CuSO4溶液可以加快产生氢气的速率 | |
| D. | 二氧化硫的催化氧化反应的△H<0,所以升高温度,反应速率减慢 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com