
下列根据实验操作和现象所得到的结论正确的是
选项 | 实验操作和现象 | 结论 |
A | 向浓度均为0.1 mol·L-1的NaCl和NaI混合溶液中滴加少量AgNO3溶液,先出现黄色沉淀 | Ksp(AgCl)<Ksp(AgI) |
B | 向苯酚浊液中加入Na2CO3溶液,溶液变澄清 | 酸性:苯酚> HCO3— |
C | 向蓝色石蕊试纸上滴加新制氯水,试纸边缘呈红色、中间为白色 | 氯水既有酸性又有还原性 |
D | 淀粉与稀硫酸混和一段时间后,滴加银氨溶液并水浴加热,无银镜出现 | 淀粉没有水解 |
 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案科目:高中化学 来源:2017届山东省高三上学期第一次月考化学试卷(解析版) 题型:实验题
下表是实验室制备气体的有关内容:
编号 | 实验内容 | 实验原理 | 发生装置 |
① | 制氧气 | H2O2→O2 | |
② | 制氨气 | NH4Cl→NH3 | |
③ | 制氯气 | HCl→Cl2 |
(1)上述气体中:从制备过程看,必须选择合适的氧化剂才能实现的是______________(填气体的化学式,下同);从反应中有无电子转移的角度看,明显不同于其他气体的是___________,写出实验室制取该气体的化学方程式
(2)根据表中所列实验原理,从下列装置中选择合适的发生装置,将其编号填入上表的空格中。
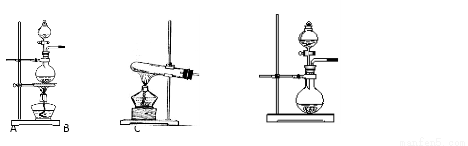
(3) 若用上述制备O2的装置制备NH3,则选择的试剂为____________________。
(4) 制备Cl2需用8 mol/L的盐酸100mL,现用12 mol/L的盐酸来配制。
①需要12 mol/L的盐酸的体积为 mL(精确到0.1 mL)
②在容量瓶的使用方法中,下列操作不正确的是 (填写标号)。
A.使用容量瓶前检查它是否漏水
B.容量瓶用蒸馏水洗净后,再用待配溶液润洗
C.配制溶液时用量筒量取浓盐酸后用玻璃棒引流入容量瓶中,缓慢加入蒸馏水到接近标线1cm~2cm处,用胶头滴管滴加蒸馏水直到凹液面的最低处和标线相平
D.定容后盖好瓶塞,用食指顶住,用另一只手手指托住瓶底,把容量瓶倒转和摇动多次
查看答案和解析>>
科目:高中化学 来源:2017届江西省等六校高三上学期第一次联考化学试卷(解析版) 题型:填空题
(1)有两种气体单质Am和Bn。已知7.2g Am和6.3 g Bn所含的原子个数相同,分子个数之比却为2∶3。又知A原子中L电子层含电子数是K电子层的3倍。通过计算回答:写出B的元素名称______
(2) 向含0.1molFeBr2的溶液中通入0.1molCl2充分反应,反应的离子方程式为___________________(写成一个离子方程式)
(3)将192克铜投入1L浓度均为2mol/L硝酸、硫酸的混合酸,充分反应生成NO______L(标准状态下)(还原产物只有NO)
(4)取100克铜、铁、银、铝金属的混合物,在足量的稀硝酸完全溶解,已知硝酸的还原产物为NO,且NO体积在标准状态下为67.2L;向所得的溶液中加入适量的2mol/L氢氧化钠溶液,则能得到沉淀最大值为______克
(5)将一定量经硫酸酸化的KMnO4溶液与FeSO4溶液混合,充分反应后再向所得溶液中加入KI溶液,混合溶液中Fe3+ 的物质的量随加入的KI的物质的量的变化关系如图所示,开始加入的KMnO4的物质的量为____________(附注:高锰酸钾将16H+ + 2MnO4- +10I- =5I2 +2Mn2+ +8H2O)
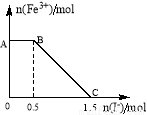
查看答案和解析>>
科目:高中化学 来源:2017届江西省等六校高三上学期第一次联考化学试卷(解析版) 题型:选择题
某非金属单质气体Y2在加热条件下,1mol Y2 (g)与80克烧碱恰好完全反应,生成NaY、H2O和另一种气体,该气体是下列中的 ( )
A、H2 B、HY C、Y2O D、O2
查看答案和解析>>
科目:高中化学 来源:2017届江苏省苏州市高三上学期期初调研化学试卷(解析版) 题型:计算题
镁铝碱式碳酸盐[MgaAlb(OH)c(CO3)d·x H2O]阻燃剂具有阻燃、消烟、填充等功能,是一种不溶于水的新型无机阻燃剂。
(1)将MgaAlb(OH)c(CO3)d·x H2O表示成氧化物形式 。
(2)为确定镁铝碱式碳酸盐的组成,进行如下实验:
准确称取15.050 g样品进行灼烧至恒重,生成CO2 0.560 L(已换算成标准状况下)。分析测得残留物中MgO为6.000 g,Al2O3为2.550 g,通过计算确定该镁铝碱式碳酸盐的化学式。(写出计算过程)
(3)该镁铝碱式碳酸盐可以由MgCl2、NaAlO2、NaOH和Na2CO3反应制备,制备的化学方程式为 。
查看答案和解析>>
科目:高中化学 来源:2017届江苏省苏州市高三上学期期初调研化学试卷(解析版) 题型:选择题
接触法制硫酸工艺三个步骤中的热化学方程式如下:
①4FeS2(s)+11O2(g)=2Fe2O3(s)+8SO2(g) △H1=―3412 kJ·mol-1
②2SO2(g)+O2(g)=2SO3(g) △H2=―196.6 kJ·mol-1
③SO3(g)+H2O(l)=H2SO4(l) △H3=―130.3 kJ·mol-1
A.反应①为吸热反应
B.反应②使用催化剂V2O5,△H2减小
C.反应③在接触室中进行
D.以FeS2为原料,理论上生产2mol H2SO4(l)所释放出的热量为1310.2 kJ
查看答案和解析>>
科目:高中化学 来源:2017届江苏省苏州市高三上学期期初调研化学试卷(解析版) 题型:选择题
燃料电池能有效提高能源利用率,具有广泛的应用前景。下列电池均可用作燃料电池的燃料,其中最环保的是
A.氢气 B.天然气 C.液化石油气 D.甲醇
查看答案和解析>>
科目:高中化学 来源:2017届四川省广元市苍溪县高三零诊理综化学试卷(解析版) 题型:填空题
铝硅合金材料性能优良。铝土矿(含30%SiO2、40.8% Al2O3、和少量的 Fe2O3等)干法制取该合金的工艺如下:
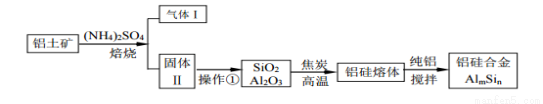
(1)铝硅合金中若含有铁,会影响其抗腐蚀性能,
原因是________________________
(2)焙烧除铁反应时,Fe2O3转化为NH4Fe(SO4 )2,Al2O3 少部分发生类似反应,写出Fe2O3反应的化学方程式: _____氧化物转化为硫酸盐的百分率与温度的关系如图,最适宜的焙烧温度是_______

(3)若操作①所得的溶液中加入过量的NaOH溶液,含铝微粒发生的离子反应方程式是:___________。
(4)用焦炭还原SiO2、 Al2O3 会产生SiC 等中间体。写出中间体SiC再与 Al2O3 生成硅、铝单质的化学反应方程式,并用单线桥标出电子转移方向和数目:_________________。
(5)已知25℃ Ksp[Al(OH)3]=1.0×10-33 , Ksp[Fe(OH)3]=4.0×10-38,向FeCl3和AlCl3的混合溶液中逐滴滴入NaOH溶液,生成Al(OH)3和Fe(OH)3 沉淀,当两种沉淀共存时,上层清液中c(Al3+):c(Fe3+)=____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com