
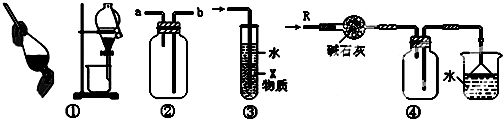
| A. | 装置①可用于分离乙醇和水的混合物 | |
| B. | 装置②可用于收集H2、NH3、CO2、Cl2、HCl、NO2等气体 | |
| C. | 装置③中X若为四氯化碳,可用于吸收氨气或氯化氢,并防止倒吸 | |
| D. | 装置④可用于干燥、收集氨气,并吸收多余的氨气 |
分析 A.乙醇和水的混合物不分层;
B.装置②中a进入收集密度比空气密度小的气体,b进入收集密度比空气密度大的气体,且不能与氧气反应;
C.X若为四氯化碳,使水和气体不能直接接触;
D.氨气可利用碱石灰干燥,利用向下排空气法收集,最后尾气处理要防止倒吸.
解答 解:A.乙醇和水的混合物不分层,则不能利用装置①中分液装置分离,故A错误;
B.装置②中a进入收集密度比空气密度小的气体,b进入收集密度比空气密度大的气体,且不能与氧气反应,则装置②可用于收集H2、NH3、CO2、Cl2、HCl、NO2等气体,故B正确;
C.X若为四氯化碳,使水和气体不能直接接触,则可用于吸收氨气或氯化氢,并防止倒吸,故C正确;
D.氨气可利用碱石灰干燥,利用向下排空气法收集,最后尾气处理要防止倒吸,则图中装置④可用于干燥、收集氨气,并吸收多余的氨气,故D正确;
故选A.
点评 本题考查化学实验方案的评价,为高频考点,涉及混合物分离提纯、气体的制备及收集等,把握物质的性质、实验基本技能为解答的关键,侧重性质与实验的考查,注意实验的可行性、评价性分析,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 金属在潮湿的空气中腐蚀的实质是:M+nH2O═M(OH)n+$\frac{n}{2}$H2↑ | |
| B. | 金属的化学腐蚀的实质是:M-ne-═Mn+,电子直接转移给还原剂 | |
| C. | 金属的化学腐蚀必须在酸性条件下进行 | |
| D. | 在潮湿的中性环境中金属的电化学腐蚀主要是吸氧腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{{V}_{1}}{{V}_{2}}$c mol•L-1 | B. | $\frac{{V}_{1}}{{V}_{2}}$c mol•L-1 | ||
| C. | $\frac{{3V}_{2}}{{V}_{1}}$c mol•L-1 | D. | $\frac{3{V}_{1}}{{V}_{2}}$c mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 有X、Z、W三种含14个电子的粒子,其结构特点如下:
有X、Z、W三种含14个电子的粒子,其结构特点如下:| 粒子代码 | X | Z | W |
| 原子核数目 | 单核 | 同种元素构成的两核 | 同种元素构成的两核 |
| 粒子的电性 | 电中性 | 两个单位负电荷 | 电中性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 用图(a)装置电解精炼铝 | |
| B. | 用图(b)装置制备Fe(OH)2 | |
| C. | 图(c)装置可制得金属钾 | |
| D. | 图(d)验证NaHCO3和Na2CO3的热稳定性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | A中的化学反应可能为:CaCO3+2HCl═CO2↑+CaCl2+H2O | |
| B. | 装置B中盛放的试剂为Na2CO3溶液 | |
| C. | 装置C中盛放的为可溶性硅酸盐 | |
| D. | 由此实验可得到的结构是:酸性HCl>H2CO3>H2SiO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(SO42-)>c(NH4+)>c(Fe2+)>c(H+)>c(OH-) | B. | c(SO42-)=c(NH4+)>c(Fe2+)>c(H+)>c(OH-) | ||
| C. | 2c(SO42-)+c(OH-)=c(NH4+)+2c(Fe2+)+c(H+) | D. | c(NH4+)+c(NH3•H2O)=2c(Fe2+)+2c[Fe(OH)2] |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应H2(g)+I2(g)?2HI(g)的平衡常数K=$\frac{c(HI)}{c({H}_{2})c({I}_{2})}$=49 | |
| B. | 反应2HI(g)?H2(g)+I2(g)的平衡常数K=$\frac{c({H}_{2})c({I}_{2})}{{c}^{2}(HI)}$=49 | |
| C. | 反应HI(g)?$\frac{1}{2}$H2(g)+$\frac{1}{2}$I2(g)的平衡常数K=$\frac{c({H}_{2})c({I}_{2})}{{c}^{2}(HI)}$=7 | |
| D. | 反应2HI(g)?H2(g)+I2(g)的平衡常数K=$\frac{c({H}_{2})c({I}_{2})}{{c}^{2}(HI)}$=$\frac{1}{49}$ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com