
【题目】大豆中含有丰富的蛋白质、脂肪等营养物质,由大豆加工出来的食品很多,深受人们喜爱。请回答下列问题:
(1)我们所吃的豆腐的主要成分是________(填写字母)。
A.凝胶 B.蛋白质 C.脂肪 D.淀粉
(2)点豆腐所采用的凝聚剂是________(填写字母)。
A.石膏 B.硫酸钡 C.氢氧化钠 D.硫酸
(3)我们食用的大豆,最终补充给人体的主要成分是________(填写字母)。
A.氨基酸 B.蛋白质 C.多肽 D.糖类
(4)大豆中含有一定量的酯类。该液态酯类的水解产物是丙三醇(俗称________)和________,其分子结构中________(填“有”或“无”)碳碳双键,丙三醇的结构简式是____________。
【答案】B A A 甘油 高级脂肪酸 有 ![]()
【解析】
大豆中含有丰富的蛋白质和油脂,将大豆磨碎制成豆浆,加入盐类使蛋白质凝聚,就可制得豆腐,豆腐是由大豆蛋白凝聚而成,人体食用后,水解成氨基酸,再合成人体所需的蛋白质或氧化以提供人体所需的能量。
大豆中的脂肪主要是油酸甘油酯,水解可得到油酸和甘油,油酸分子内含有碳碳双键,可使溴水或酸性高锰酸钾溶液褪色。
(1)通过以上简析,我们所吃的豆腐主要由大豆蛋白凝聚而成,它的主要成分是蛋白质,故选B。答案为:B;
(2)点豆腐就是加入某种可溶性盐溶液,将豆浆蛋白质凝聚。硫酸钡难溶于水,不能使蛋白质凝聚,氢氧化钠和硫酸会使蛋白质变性而后水解,且它们对人体不利,综合以上分析,所采用的凝聚剂是A。答案为:A;
(3)我们食用的大豆,蛋白质在蛋白酶的催化作用下发生水解,最终转化为氨基酸,所以应选A。答案为:A;
(4)大豆中含有一定量的酯类。该液态酯类主要是高级脂肪酸甘油酯,它的水解产物是丙三醇(俗称甘油)和高级脂肪酸,高级脂肪酸分子中含有碳碳双键,则油脂分子结构中也有碳碳双键,丙三醇的结构简式是![]() 。答案为:甘油;高级脂肪酸;有;
。答案为:甘油;高级脂肪酸;有;![]() 。
。


科目:高中化学 来源: 题型:
【题目】一定条件下,将NO(g)和O2(g)按物质的量之比2∶1充入反应容器,发生反应:2NO(g) + O2(g) ![]() 2NO2(g)。其他条件相同时,分别测得NO的平衡转化率在不同压强(p1、p2)下随温度变化的曲线如下图所示。下列说法正确的是
2NO2(g)。其他条件相同时,分别测得NO的平衡转化率在不同压强(p1、p2)下随温度变化的曲线如下图所示。下列说法正确的是

A. p1 < p2
B. 其他条件不变,温度升高,该反应的反应限度增大
C. 400℃、p1条件下,O2的平衡转化率为20%
D. 400℃时,该反应的化学平衡常数的数值为10/9
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知干冰晶胞属于面心立方最密堆积,晶胞中相邻最近的两个CO2分子间距为a pm,阿伏加德罗常数为NA,下列说法正确的是
A.晶胞中一个CO2分子的配位数是8
B.晶胞的密度表达式是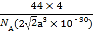 g·cm-3
g·cm-3
C.一个晶胞中平均含6个CO2分子
D.CO2分子的立体构型是直线形,中心C原子的杂化类型是sp3杂化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】药物瑞德西韦对新型冠状病毒(COVID-19)有明显抑制作用。K是合成瑞德西韦的关键中间体,其合成路线如下:
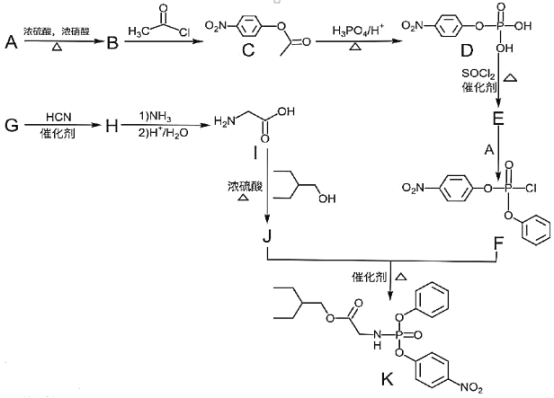
①R-OH![]() R-Cl;
R-Cl;
②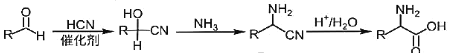
回答下列问题:
(1)B的结构简式为_________________________,B→C的反应类型为_____________,J中含氧官能团的名称为_______________,G→H的反应化学方程式为_____________________________________________。
(2)写出符合下列条件的C的同分异构体X__________________________(填结构简式,不考虑立体异构)。
①苯环上含有硝基且苯环上只有一种氢原子; ②与FeCl3溶液发生显色反应; ③1molX与足量金属Na反应可生成2g H2 。
(3)E中含两个Cl原子,则E的结构简式为________________________________________________。
(4)写出以苯甲醇为原料制备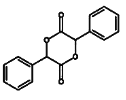 的合成路线(其它试剂任选):________________。
的合成路线(其它试剂任选):________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)常用垃圾处理方法有三种:
①________法,可以产生大量肥料;
②________法,可以避免露天堆放产生的问题;
③_____法,可以使垃圾体积缩小,能彻底消灭病原体以及产生热量等优点。
(2)回收利用垃圾资源是现代生活不可忽视的重要活动。请举出生活垃圾回收利用的一个事例:_________。
(3)回收利用垃圾,首先要对垃圾进行分类,一群环保志愿者在某社区推广垃圾分类,他们在垃圾房放置了一些有分类标志的垃圾回收箱,结果却发现有许多居民并没有分类放置。造成这种现象的原因可能是________。
A.居民嫌麻烦,没有垃圾分类的习惯 B.居民每天产生的垃圾量非常多
C.居民的环保意识不强 D.居民不清楚垃圾分类的标准
(4)
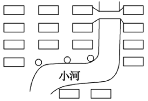
上图是某居民小区中垃圾收集点(小圆圈)的布局,它在选址上存在的两个问题是_________和________。垃圾收集点选址应考虑的因素包括(提出三点)________、________、________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述不正确的是( )
A. CCl4可由CH4制得,可萃取碘水中的碘
B. 乙烯和甲苯分子中所有原子都在同一个平面上
C. 煤油可由石油分馏获得,可用作燃料和保存少量金属钠
D. ![]() 和CH3-CH=CH2互为同分异构体
和CH3-CH=CH2互为同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】次氯酸溶液是常用的消毒剂、漂白剂。某学习小组根据需要欲制备浓度不小于0.8mol/L的次氯酸溶液。
(查阅资料)
资料1:常温常压下,Cl2O为棕黄色气体,沸点为 3.8 ℃,42 ℃以上会分解生成 Cl2和O2, Cl2O易溶于水并与水立即反应生成 HClO。
资料2:将氯气和空气(不参与反应)按体积比 1∶3 混合通入潮湿的碳酸钠中发生反应2Cl2+2Na2CO3+H2O![]() Cl2O+2NaCl+2NaHCO3,用水吸收 Cl2O(不含Cl2)制得次氯酸溶液。
Cl2O+2NaCl+2NaHCO3,用水吸收 Cl2O(不含Cl2)制得次氯酸溶液。
(装置及实验)用以下装置制备次氯酸溶液

回答下列问题:
(1)各装置的连接顺序为_____→_____→_____→____→E。
(2)装置 A 中反应的离子方程式是______。
(3)装置 E中反应的化学方程式是_____。
(4)装置 B 中多孔球泡和搅拌棒的作用是_______;反应过程中,装置B需放在冷水中,其目的是_____。
(5)装置 C 的主要作用是_____。
(6)此方法相对于用氯气直接溶于水制备次氯酸溶液的优点是(答出一条即可)_____。
(7)若装置B中生成的Cl2O气体有20%滞留在E前各装置中,其余均溶于装置E的水中,装置E所得500mL次氯酸溶液浓度为0.8mol/L,则至少需要含水8%的碳酸钠的质量为___g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸四氨合铜晶体([Cu(NH3)4]SO4·H2O)常用作杀虫剂、媒染剂,也是高效安全的广谱杀菌剂。常温下该物质在空气中不稳定,受热时易发生分解。某化学兴趣小组设计如下方案来合成硫酸四氨合铜晶体并测定晶体中氨的含量。
I.CuSO4溶液的制备
①取4g铜粉,在仪器A中灼烧10分钟并不断搅拌使其充分反应。
②将A中冷却后的固体转移到烧杯中,加入25 mL 3 mol·L-1H2SO4溶液,加热并不断搅拌至固体完全溶解。
(1)①中仪器A的名称为______________。
(2)②中发生反应的离子方程式为__________________。
Ⅱ.晶体的制备
将I中制备的CuSO4溶液按如图所示进行操作:

(3)向硫酸铜溶液中逐滴加入氨水至过量的过程中,可观察到的实验现象是____________。
(4)缓慢加入乙醇会析出晶体的原因是________________________________;若将深蓝色溶液浓缩结晶,在收集到的晶体中可能混有的杂质主要有______________(写其中一种物质的化学式)。
III.氨含量的测定
精确称取wg晶体,加适量水溶解,注入如图所示的三颈瓶中,然后逐滴加入足量10%NaOH溶液,通入水蒸气,将样品液中的氨全部蒸出,用盐酸标准溶液完全吸收。取下接收瓶,再用NaOH标准溶液滴定剩余的盐酸溶液(选用甲基橙作指示剂)。

1.水 2.玻璃管 3.10%氢氧化钠溶液 4.样品液 5.盐酸标准溶液 6.冰盐水
(5)装置中玻璃管的作用是__________________________________________________。
(6)在实验装置中,若没有使用冰盐水冷却会使氨含量测定结果________(填“偏高”、“偏低”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨是人类科学技术上的一项重大突破,其反应原理为:![]() △H=-92.4kJ·L-1,一种工业合成氨的简易流程图如下:
△H=-92.4kJ·L-1,一种工业合成氨的简易流程图如下:
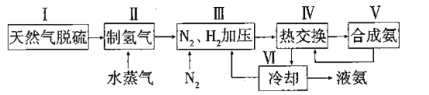
(1)步骤II中制氯气原理如下:
I.![]() △H=+206.4kJ·L-1
△H=+206.4kJ·L-1
II.![]() △H=-41.2kJ·L-1
△H=-41.2kJ·L-1
①对于反应I,一定可以提高平衡体系中H2百分含量,又能加快反应速率的是____________________。
a.升高温度 b.增大水蒸气浓度 c.加入催化剂 d.降低压强
②利用反应II,将CO进一步转化,可提高H2产量。若1mol CO和H2的混合气体(CO的体积分数为20%)与H2O反应,得到1.18molCO、CO2和H2的混合气体,则CO转化率为_______________。
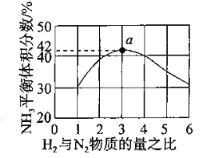
(2)图1表示500℃、60.0Mpa条件下,原料气投料比平衡时NH3体积分数的关系。根据图中a点数据计算N2的平衡体积分数:________。
(3)上述流程图中,使合成氨气放出的能量得到充分利用的主要步骤是(填序号)________。简述本流程中提高合成氨原料总转化率的方法:_______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com