
【题目】钇的常见化合价为+3价,我国蕴藏着丰富的含钇矿石(Y2FeBe2Si2O10),工业上通过如下生产流程可获得氧化钇。

已知:①该流程中有关金属离子形成氢氧化物沉淀时的pH见下表:
离子 | 开始沉淀时的pH | 完全沉淀时的pH |
Fe3+ | 2.1 | 3.1 |
Y3+ | 6.0 | 8.2 |
②在元素周期表中,铍元素和铝元素处于第二周期和第三周期的对角线位置,化学性质相似。
(1)写出Na2SiO3的一种用途________________________。
(2)欲从Na2SiO3和Na2BeO2混合溶液中制得Be(OH)2沉淀。
① 最好选用盐酸和_______两种试剂,再通过必要的操作即可实现。
A.NaOH溶液 B.氨水 C.CO2 D.HNO3
② 写出Na2BeO2与足量盐酸发生反应的离子方程式___________________________。
(3)常温下,反应Fe3++3H2O(g) ![]() Fe (OH)3↓+3H+的平衡常数K= ______。为使Fe3+沉淀完全,用氨水调节pH=a时,a应控制在_________范围内;继续加氨水调节pH =b发生反应的离子方程式为____________________________。
Fe (OH)3↓+3H+的平衡常数K= ______。为使Fe3+沉淀完全,用氨水调节pH=a时,a应控制在_________范围内;继续加氨水调节pH =b发生反应的离子方程式为____________________________。
(4)煅烧草酸钇时发生分解反应,其固体产物为氧化钇,气体产物能使澄清石灰水变浑浊。写出草酸钇[Y2(C2O4)3·nH2O]煅烧的化学方程式___________________________________。
【答案】工业粘合剂、制备硅胶、木材防火剂等 B BeO22-+4H+===Be2++2H2O 10-4.3 3.1~6.0 Y3++3NH3·H2O=Y(OH)3↓+3NH4+ Y2(C2O4)3·nH2O![]() Y2O3+3CO↑+3CO2↑+nH2O
Y2O3+3CO↑+3CO2↑+nH2O
【解析】
由铍元素和铝元素化学性质相似入手,可分析制得Be(OH)2沉淀的试剂及方程式,结合题干信息推测相应生成物,进而写出相应方程式。
(1)Na2SiO3俗称水玻璃,常用于工业粘合剂、制备硅胶、木材防火剂等;
(2)①周期表中,铍、铝元素处于第二周期和第三周期的对角线位置,化学性质相似,欲从Na2SiO3和Na2BeO2的混合溶液中制得Be(OH)2沉淀,根据Na2BeO2的性质和NaAlO2类比推断;加过量的盐酸,硅酸钠反应生成硅酸沉淀,Na2BeO2的反应生成氯化铍溶液,再加入过量氨水沉淀铍离子,故答案为B;②Na2BeO2与足量盐酸发生反应生成氯化铍、氯化钠和水,反应的离子方程式为:BeO22-+4H+=Be2++2H2O;
(3)当c(Fe3+)=10-5mol/L时达到平衡,由![]() ,三价铁离子开始沉淀到沉淀完全的pH范围为:2.1-3.1;钇离子开始沉淀和沉淀完全的pH为:6.0-8.2;所以使Fe3+沉淀完全,须用氨水调节pH=a,3.1<a<6.0;继续加氨水调节pH=b发生反应的离子方程式为:Y3++3NH3H2O=Y(OH)3↓+3NH4+;检验三价铁离子是否沉淀完全需要检验滤液中是否含有三价铁离子,结合三价铁离子检验试剂是硫氰酸钾溶液变血红色;取少量滤液,滴加几滴KSCN溶液,观察溶液是否变为血红色,若不变血红色,则说明Fe3+完全沉淀,反之则未完全沉淀;
,三价铁离子开始沉淀到沉淀完全的pH范围为:2.1-3.1;钇离子开始沉淀和沉淀完全的pH为:6.0-8.2;所以使Fe3+沉淀完全,须用氨水调节pH=a,3.1<a<6.0;继续加氨水调节pH=b发生反应的离子方程式为:Y3++3NH3H2O=Y(OH)3↓+3NH4+;检验三价铁离子是否沉淀完全需要检验滤液中是否含有三价铁离子,结合三价铁离子检验试剂是硫氰酸钾溶液变血红色;取少量滤液,滴加几滴KSCN溶液,观察溶液是否变为血红色,若不变血红色,则说明Fe3+完全沉淀,反之则未完全沉淀;
(4)煅烧草酸钇时发生分解反应,其固体产物为氧化钇,气体产物能使澄清石灰水变浑浊,说明有CO2气体产生,草酸钇[Y2(C2O4)3·nH2O]煅烧的化学方程式为Y2(C2O4)3·nH2O![]() Y2O3+3CO↑+3CO2↑+nH2O。
Y2O3+3CO↑+3CO2↑+nH2O。


科目:高中化学 来源: 题型:
【题目】用下列实验装置进行相应的实验,能达到实验目的的是
A.  所示装置进行用已知浓度的氢氧化钠溶液测定盐酸浓度的实验
所示装置进行用已知浓度的氢氧化钠溶液测定盐酸浓度的实验
B.  所示装置验证二氧化硫的漂白性
所示装置验证二氧化硫的漂白性
C.  所示装置分离四氯化碳和苯的混合物
所示装置分离四氯化碳和苯的混合物
D.  所示装置检验氯化铵受热分解生成的两种气体
所示装置检验氯化铵受热分解生成的两种气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在溶液中Br2可氧化二氧化硫:Br2+SO2+2H2O→2HBr+H2SO4,如图是有关二氧化硫性质的实验装置图,试回答下列问题:

(1)写出实验室制SO2的化学方程式:____。
(2)二氧化硫具有:①漂白性 ②酸性氧化物的性质 ③还原性 ④氧化性,在上图几个装置中对应表现出的性质是(填序号):
A中___B中____C中___D中____
(3)有四位同学设计下列四个方案检验E溶液中是否含有SO42-,你认为合理的是(_____)
A.试液![]() 白色沉淀
白色沉淀![]() 沉淀不溶解
沉淀不溶解
B.试液![]() 无沉淀
无沉淀![]() 白色沉淀
白色沉淀
C.试液![]() 无沉淀
无沉淀![]() 白色沉淀
白色沉淀
D.试液![]() 无沉淀
无沉淀![]() 白色沉淀
白色沉淀
(4)实验完毕后,将B中溶液取少量于试管中加热,现象是___,原因是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,纵坐标表示导电能力,横坐标表示所加溶液的量,以下各组反应符合该图的是( )

A.CH3COOH溶液中滴加KOH溶液
B.NaOH溶液中滴加稀HCl
C.Ba(OH)2溶液中滴加稀H2SO4
D.Cu(OH)2悬浊液中滴加HNO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据要求完成下列实验。(a、b为弹餐夹,其他装置略去)
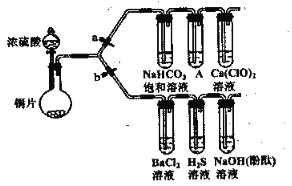
I验证SO2具有氧化性、还原性和酸性氧化物的通性。
(1) 连接仪器、检查装置气密性、加药品后,打开b (关闭a),然后滴入浓硫酸,加热。装有浓硫酸的仪器名称是___________,铜与浓硫酸反应的化学方程式是___________ 。
(2) 能验证SO2具有氧化性的实验现象是__________________________________________。
(3) 装有BaCl2溶液的试管中无任何现象,将其分成两份,分别滴加氨水和氯水,均产生白色沉淀,沉淀的化学式分别是___________,___________。写出其中SO2显示还原性并生成白色沉淀的总的离子方程式____________________________________________。
(4) 能验证SO2具有酸性氧化物的通性的实验现象是________________________________, 若通入过量的SO2,其化学方程式是____________________________________________。
II验证酸性的相对强弱:碳酸>次氯酸。(已知酸性:亚硫酸>碳酸)
(5) 打开a关闭b。装置A中的足量的试剂是___________。利用该装置能否判断碳酸的酸性比次氯酸强,理由是_______________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硒化锌是一种透明黄色半导体,也可作红外光学材料,熔点1520℃。
(1)锌离子的电子排布式是_____________。
(2)根据元素周期律,电负性S______Se,第一电离能Se______As(填“>”或“<”)。
(3)H2O的沸点______________(填“>”或“<”)H2Se的沸点,其原因是:______。
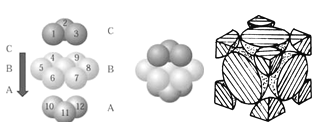
(4)NaCl晶胞如图所示,阴、阳离子都具有球型对称结构,它们都可以看做刚性圆球,并彼此“相切”。晶胞中Na+的配位数为____,若晶胞参数为a pm,阿伏加德罗常数的值用NA表示,若晶体密度为_______g·cm﹣3。(列出表达式)。

(5)铜晶体中铜原子的堆积方式如图所示,铜晶体中原子的堆积模型属于_______。若已知铜的原子半径为rcm,表示原子空间占有率的表达式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H3AsO4水溶液中含砷的各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH的关系如下图所示(已知pKa=-lgKa),下列说法正确的是

A. H3AsO4溶液pKa2为4.5
B. NaH2AsO4溶液显碱性
C. 常温下,m点对应溶液中由水电离出的OH—浓度为10—11.5 mol/L
D. n点对应溶液中,离子浓度关系:c(HAsO42—)=c(H2AsO4—)>c( OH—) =c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)系统命名法命名下列物质:
 __________________________________;
__________________________________;
(2)书写下列物质的结构简式:
①2,6-二甲基-4-乙基辛烷:______________;②间三甲苯______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是温度和压强对X + Y ![]() 2Z 反应影响的示意图。图中横坐标表示温度,纵坐标表示平衡混合气体中Z的体积分数。下列叙述正确的是( )
2Z 反应影响的示意图。图中横坐标表示温度,纵坐标表示平衡混合气体中Z的体积分数。下列叙述正确的是( )

A. 上述可逆反应的正反应为吸热反应
B. X、Y、Z均为气态
C. X和Y是气态,Z为固态
D. 上述反应的逆反应的△H>0
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com