
| A、X离子的半径比Z离子的半径大 |
| B、Y的氧化物是良好的半导体材料 |
| C、Z的氢化物比W的氢化物的还原性更强 |
| D、X和W的化合物中含有共价键和离子键 |


科目:高中化学 来源: 题型:
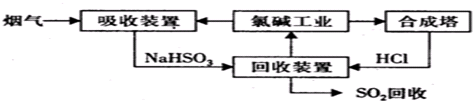

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、(NH4)2SO4 和NH4Cl |
| B、NH4HCO3和NH4Cl |
| C、NH4H2PO4和 NH4HCO3 |
| D、(NH4)2SO4 和NH4NO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、3种 | B、6种 | C、9种 | D、12种 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、角鲨烯分子式为C30H50 |
| B、1mol角鲨烯最多可与6mol溴单质加成 |
| C、角鲨烯与分子式为C29H48的物质可能属于同系物 |
| D、角鲨烯是高分子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、BaCl2+K2SO4═BaSO4+2 KCl |
| B、Ba(OH)2+K2SO4═BaSO4+2 KOH |
| C、Ba(NO3)2+H2SO4═BaSO4+2 HNO3 |
| D、Ba(OH)2+H2SO4═BaSO4+2 H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com