
【题目】掌握仪器的名称、组装及使用方法是中学化学实验的基础,根据如图所示实验装置,回答下列问题。
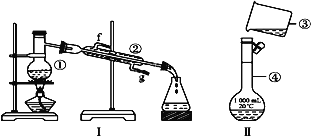
(1)写出下列仪器的名称:①______________,②_____________,④____________。
(2)仪器①~④中,使用时必须检查是否漏水的是____________(填序号)。
(3)若分离酒精和水的混合物,分离方法为___________,该方法适用于分离________不同的混合物,若利用装置Ⅰ分离酒精和水的混合物,还缺少的仪器是_____________;②的进水口是____________(填“f”或“g”)。
科目:高中化学 来源: 题型:
【题目】下表是利用无土栽培法培养蔬菜时,培养液中元素的配方,其中根细胞吸收最少的是
离子 | K+ | M g2+ | Ca2+ | NO3- | H2PO4- | SO42- | Zn2+ |
培养液浓度(mol/L) | 1 | 0.25 | 1 | 2 | 1 | 0.25 | 1 |
A. H2PO4-B. SO42-C. Ca2+D. Zn 2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验的图示及分析均正确的是
选项 | 实验目的 | 实验图示 | 实验分析 |
A | 实验室用酸性高锰酸钾溶液滴定草酸溶液 |
| 摇瓶时,使溶液向一个方向做圆周运动,勿使瓶口接触滴定管,溶液也不得溅出。 |
B | 石油分馏时接收馏出物 |
| 为收集到不同沸点范围的馏出物,需要不断更换锥形瓶。 |
C | 测定锌与稀硫酸反应生成氢气的速率 |
| 实验中,需测定的物理量是反应时间和生成氢气的体积。 |
D | 用四氯化碳萃取碘水中的碘 |
| 充分振荡后静置,待溶液分层后,先把上层液体从上口倒出,再让下层液体从下口流出。 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碲(Te)是一种第VIA族分散稀有元素,主要伴生于铜、镍、铅等金属矿藏中。TeO2属于两性氧化物,难溶于水,易溶于强酸和强碱。工业上可从电解精炼铜的阳极泥(主要成分Cu2Te,还有少量的Ag、Au)中提取碲。其工艺流程如下:
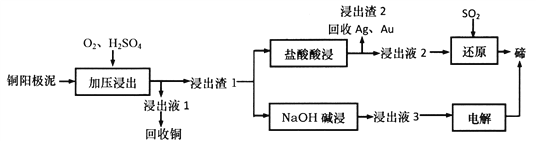
(1)“加压浸出”生成TeO2的离子方程式为________________________,“加压浸出”时控制pH为4.5~5.0,酸性不能过强的原因是_________________________________。
(2)“盐酸酸浸”后将SO2通入浸出液即可得到单质碲,该反应中氧化剂与还原剂物质的量之比为________________,该流程中可循环利用的物质是_____________(填化学式)。
(3)已知:Ksp(Ag2SO4)=7.70×10-5,Ksp(AgC1)=1.80×10-10。盐酸酸浸时,“浸出渣1”中Ag2SO4可充分转化为AgC1。通过计算说明为什么可以实现充分转化_________________。
(4)NaOH碱浸时反应的离子方程式为__________________。流程中,电解过程用石墨为电极得到碲,阴极的电极反应式为__________________________________。
(5)浸出法是工业提取金属常用的方法,某实验小组用1.0mol· L-1的草酸在75℃时浸出镍。随时间变化,不同固液比对镍浸出率的影响曲线如图所示。
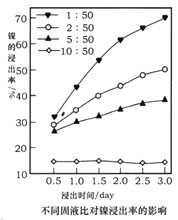
①由图可知,固液比与镍浸出率的关系是______________________。
②除固液比之外,你认为影响金属浸出率的因素还有____________________(至少两项)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学——选修3:物质结构与性质】电化学还原技术是一种处置CO2的绿色环保、有发展潜力的方法。铜、铂、铟(In)等金属都是该反应的催化剂。
(1)In元素基态原子的价电子排布式为____________。与Cu元素同周期,且基态原子有2个未成对电子的过渡元素是_________________(填元素符号)。
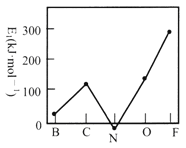
(2)第一电子亲和能(E1)是元素的基态气态原子得到一个电子形成气态负一价离子时所放出的能量。第二周期部分元素的E1变化趋势如图所示。试分析碳元素的E1较大的原因_____________________________。
(3)[PtC14(NH3)2]中N原子的杂化方式为________,所含化学键类型包括_______(填字母)。
a.离子键b.共价键c.金属键d.配位键e.氢键
[PtCl4(NH3)2]中H-N-H键之间夹角______(填“>”“<”或“=”)NH3分子中H-N-H键之间夹角,原因是__________________________________。
(4)C60晶体可采取非最密堆积,然后在空隙中插入金属离子获得超导体,如图为K3C60的面心立方晶胞。则K+占据的是C60围成的正四面体空隙和_____空隙,若C60分子的原子坐标参数分别为A(0,0,0),B(![]() ),C(1,1,1)等,则距离A位置C60分子最近的K+的原子坐标参数为_____________。判断晶体熔沸点高低:C60_________K3C60(填“>”“<”或“=”)。
),C(1,1,1)等,则距离A位置C60分子最近的K+的原子坐标参数为_____________。判断晶体熔沸点高低:C60_________K3C60(填“>”“<”或“=”)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下是有关金属与酸的反应,请填写下列空白:
(1)分别取W g钠、铁、铝与足量的盐酸反应,在相同条件下产生氢气的体积比是__________。
(2)分别取0.1 mol钠、铁、铝与足量的盐酸反应,在相同条件下产生氢气的体积比是_________。
(3)若产生相同物质的量的氢气,所需钠、铁、铝的质量比是___________________。
(4)若产生相同体积(同温同压)的氢气,所需钠、铁、铝的物质的量之比是_______________。
(5)分别取0.2 mol的金属钠、铁、铝分别投入10 mL 1 mol/L的盐酸中,标况下产生氢气的体积由大到小的顺序是______________。[钠、铁、铝产生氢气的体积分别用V1、V2、V3表示]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是
A. 金属铜与硝酸银溶液反应:Cu+Ag+ =Cu2++Ag
B. Ba(OH)2溶液和H2SO4溶液反应:Ba2+ + OH- + H+ + SO42- = BaSO4↓+ H2O
C. 向沸水中滴加FeCl3溶液制备Fe(OH)3胶体:Fe3++3H2O![]() Fe(OH)3↓+3H+
Fe(OH)3↓+3H+
D. 石灰乳与盐酸反应:Ca(OH)2+2H+ = Ca2++2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学——选修3:物质结构与性质】已知Fe、HCN与K2CO3在一定条件下发生如下反应:Fe+6HCN+2K2CO3=K4Fe(CN)6+H2↑+2CO2↑+2H2O,回答下列问题:
(1)金属铁的紧密堆积方式为_______________,其配位数为_____________________。
(2)HCN 分子的结构式为___________,与CN-互为等电子体的阴离子是_________________。
(3)K2CO3中阴离子的空间构型为_______________,CO2为_____________分子(填“极性”或“非极性”),H2O中O原子的杂化轨道类型为_______________。
(4)配合物K4Fe(CN)6的中心离子的电子排布式为__________________。
(5)上述化学方程式中C、N、O的第一电离能由小到大的顺序为________________________。
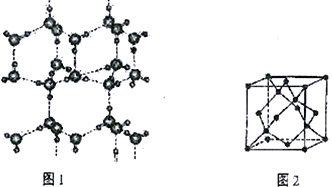
(6)冰的晶体结构模型如图1,它的晶胞与金刚石的晶胞相似,如图2,水分子之间以氢键相连接,在一个晶胞中有_____个氢键,若氢键键长为d nm,则晶体密度(g·cm-3)计算式为___________ (用NA 表示阿伏加德罗常数的值。)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向25 ℃时的纯水中通入一定量的HCl气体,当溶液的pH=2时,则由水电离出的c(H+)是
A. 1×10-2 mol·L-1 B. 1×10-8 mol·L-1
C. 1×10-12 mol·L-1 D. 1×10-4 mol·L-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com