
【题目】砷(As)是一些工厂和矿山废水中的污染元素,使用吸附剂是去除水中砷的有效措施之一。
(1)将硫酸锰、硝酸钇与氢氧化钠溶液按一定比例混合,搅拌使其充分反应,可获得一种砷的高效吸附剂X,吸附剂X中含有CO32-,其原因是____。
(2)H3AsO3和H3AsO4水溶液中含砷的各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH的关系分别如图1和图2所示。


①以酚酞为指示剂(变色范围pH8.0~10.0),将NaOH溶液逐滴加入H3AsO3溶液中,当溶液由无色变为浅红色时停止滴加。该过程中主要反应的离子方程式为____。
②H3AsO4第一步电离方程式H3AsO4![]() H2AsO4-+H+的电离常数为Ka1,则pKa1=___(pKa1=-lgKa1)。
H2AsO4-+H+的电离常数为Ka1,则pKa1=___(pKa1=-lgKa1)。
(3)溶液的pH对吸附剂X表面所带电荷有影响。pH=7.1时,吸附剂X表面不带电荷;pH>7.1时带负电荷,pH越高,表面所带负电荷越多;pH<7.1时带正电荷,pH越低,表面所带正电荷越多。pH不同时吸附剂X对三价砷和五价砷的平衡吸附量(吸附达平衡时单位质量吸附剂X吸附砷的质量)如图3所示。

①在pH7~9之间,吸附剂X对五价砷的平衡吸附量随pH升高而迅速下降,其原因是___。
②吸附剂X对水中三价砷的去除能力远比五价砷的弱,这是因为___,提高吸附剂X对三价砷去除效果可采取的措施是___。
【答案】碱性溶液吸收了空气中的CO2 OH-+H3AsO3=H2AsO3-+H2O 2.2 在pH7~9之间,随pH升高H2AsO4-转变为HAsO42-,吸附剂X表面所带负电荷增多,静电斥力增强 在pH4~7之间,吸附剂X表面带正电荷,五价砷主要以H2AsO4-和HAsO42-阴离子存在,静电引力较大;而三价砷主要以H3AsO3分子存在,与吸附剂X表面产生的静电引力小 加入氧化剂,将三价砷转化为五价砷
【解析】
(1)氢氧化钠溶液吸收二氧化碳生成碳酸钠和水。
(2)①当溶液由无色变为浅红色时停止滴加,溶液pH为8~10,H3AsO3减少、H2AsO3-增多;
②Ka1=![]() ,K仅与温度有关;
,K仅与温度有关;
(3)①pH>7.1时吸附剂X表面带负电荷,pH越高,表面所带负电荷越多;
②在pH4~7之间,吸附剂X表面带正电荷,五价砷主要以H2AsO4-和HAsO42-阴离子存在;而三价砷主要以H3AsO3分子存在。
(1)吸附剂X中含有NaOH溶液,能吸收空气中的CO2生成CO32-。
(2)①图1中pH为8~10时,三价砷物种主要以H3AsO3和H2AsO3-的形式存在,故滴加NaOH溶液的过程中主要反应的离子方程式为OH-+H3AsO3=H2AsO3-+H2O。
②Ka1=![]() ,K仅与温度有关,为方便计算,在图2中取pH=2.2时计算,此时c(H2AsO4-)=c(H3AsO4),则Ka1=c(H+)=10-2.2,pKa1=2.2。
,K仅与温度有关,为方便计算,在图2中取pH=2.2时计算,此时c(H2AsO4-)=c(H3AsO4),则Ka1=c(H+)=10-2.2,pKa1=2.2。
(3)①从图2知,pH由7升至9时,H2AsO4-转变为HAsO42-,由题中信息知,pH>7.1时,pH越高,吸附剂X所带负电荷越多,则吸附剂X与HAsO42-的静电斥力增强。
②在pH为4~7时,吸附剂X表面带正电荷,从图2知,pH在4~7之间时,吸附剂X吸附H2AsO4-和HAsO42-;从图1知,pH在4~7之间时,三价砷主要以分子形式存在,二者静电引力小。加入氧化剂,可以将三价砷转化为五价砷,而被吸附剂X吸附。


科目:高中化学 来源: 题型:
【题目】下列反应方程式不正确的是
A.氯气与水反应的离子方程式:Cl2+H2O![]() HClO+H++Cl-
HClO+H++Cl-
B.制备硝基苯的化学方程式:![]() +HO-NO2
+HO-NO2![]()
![]() NO2+H2O
NO2+H2O
C.碳酸钾水解的离子方程式:CO32-+2H2O=H2CO3+2OH-
D.钠与水反应的离子方程式:2Na+2H2O=2Na++2OH-+H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知图①一④的相关信息,下列相应叙述正确的是
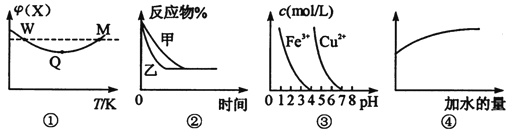
A.图①表示向恒容密闭容器中充入X和Y发生反应:2X(g)+Y(g)![]() 3Z(g) △H<0,W点X的正反应速率等于M点X的正反应速率
3Z(g) △H<0,W点X的正反应速率等于M点X的正反应速率
B.图②表示压强对可逆反应A(g)+2B(g)![]() 3 C(g)+D(s)的影响,乙的压强比甲压强小
3 C(g)+D(s)的影响,乙的压强比甲压强小
C.据图③,若要除去CuSO4溶液中的Fe3+,可加入NaOH溶液至pH在4左右
D.常温下,稀释0.1 mol·L-1Na2CO3溶液,图④中的纵坐标可以表示溶液中HCO3-的数目
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有①氨水 ②NH4Cl溶液 ③Na2CO3溶液 ④NaHCO3溶液各25 mL,物质的量浓度均为0.1 mol/L,下列说法正确的是
A. 4种溶液pH的大小顺序:①>④>③>②
B. 溶液①、②等体积混合后pH > 7,则c(NH4+) < c(NH3·H2O)
C. 向溶液①、②中分别加入25 mL 0.1mol/L盐酸后,溶液中c(NH4+):①>②
D. 向溶液③、④中分别加入12.5 mL 0.1mol/L NaOH溶液后,两溶液中的离子种类相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,向1.0L密闭容器中加入0.60molX(g),发生反应X(g)=Y(s)+2Z(g) ΔH>0,反应达到最大限度前,测得X的浓度与反应时间的数据如表所示:
反应时间t/min | 0 | 1 | 2 | 3 | 4 | 6 | 8 |
c(X)/mol·L-1 | 0.60 | 0.42 | 0.30 | 0.21 | 0.15 | a | 0.0375 |
试回答下列问题:
(1)0~3min内,用Z表示的平均反应速率v(Z)=___。
(2)分析该反应中反应物的浓度随时间的变化规律,得出的结论是___。由此结论推出a为___。
(3)该反应的逆反应速率随时间变化的关系如图所示,t2时改变了某一反应条件,则改变的条件为___。
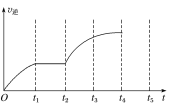
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化氯(ClO2)是一种高效消毒剂,易溶于水,沸点为11.0℃,极易爆炸分解,若用空气、二氧化碳、氮气等惰性气体稀释时,爆炸性则降低。用干燥的氯气与固体亚氯酸钠制备二氧化氯,装置如图:

(1)仪器a的名称为___________,装置A中反应的离子方程式为____________________。
(2)试剂X的作用是_____________________________。
(3)装置D中通入干燥空气的作用是______________________________。
(4)该实验装置的缺陷是_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验方案中,能达到相应实验目的的是
实验方案 |
|
|
|
|
目的 | A.比较乙醇分子中羟基氢原子和水分子中氢原子的活泼性 | B.除去乙烯中的二氧化硫 | C.制银氨溶液 | D.证明碳酸酸性强于苯酚 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,在20mL0.1mol/L HR 溶液中滴加0.1000mol/LNaOH溶液,混合溶液的PH与所加NaOH溶液体积的关系如图所示。下列推断正确的是

A. ①、②、③三点中,③对应的溶液中c水(H+)·c水(OH-)最大
B. HR溶液中只存在H+、R-、OH-、H2O四种微粒
C. ②点溶液中一定存在c(Na+)>c(R-)>c(H+)=c(OH-)
D. NaR的水解常数Ka和水解程度:③>②>①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Bodensteins 研究了反应 2HI(g)![]() I2(g)+ H2(g),某温度下,上述反应中,正反应速率为υ正=k正c2(HI),逆反应速率为υ逆=k逆c(I2)·c(H2),,其中k正、k逆为速率常数,根据以上内容得出的结论,不正确的是
I2(g)+ H2(g),某温度下,上述反应中,正反应速率为υ正=k正c2(HI),逆反应速率为υ逆=k逆c(I2)·c(H2),,其中k正、k逆为速率常数,根据以上内容得出的结论,不正确的是
A.反应物浓度越大,正反应速率越大
B.生成物浓度越大,逆反应速率越大
C.该反应的平衡常数K =k正/k逆
D.速率常数的大小与反应程度无关系
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com