
| A. | 0.01 mol•L-1HA溶液的pH=4 | B. | HA溶液跟锌反应,放出H2很慢 | ||
| C. | pH=2的HA溶液稀释100倍后pH=3.5 | D. | 溶液中存在HA的电离平衡 |
分析 要证明一元酸HR为弱酸,可证明存在电离平衡、不能完全电离或从对应的强碱盐溶液呈碱性的角度,以此解答该题.
解答 解:A.常温下,测得0.01 mol/LHA溶液的pH=4,说明HA没有完全电离,可证明HA为弱酸,故A不选;
B.HA溶液跟锌反应,生成氢气的快慢与溶液的浓度有关,不能根据放出H2很慢,判断为弱酸,如果是强酸浓度很小生成氢气的速率也很小,故B选.
C.常温下,将pH=2的HA溶液稀释100倍,测得pH=3.5,说明加水稀释促进电离,如为强酸,稀释后pH=4,所以可证明为弱酸,故C不选;
D.溶液中存在HA的电离平衡,说明HA为弱酸不能完全电离,故D不选;
故选B.
点评 本题考查实验方案的评价,侧重于弱酸的实验角度的探究,注意把握实验原理和角度,学习中注意相关基础知识的积累,题目难度不大.


 一本好题口算题卡系列答案
一本好题口算题卡系列答案科目:高中化学 来源: 题型:解答题
| 溶液中溶质质量分数 | 4% | 12% | 16% | 24% | 28% |
| 硫酸溶液的密度/(克/厘米3) | 1.02 | 1.08 | 1.11 | 1.17 | 1.20 |
| 氨水的密度/(克/厘米3) | 0.98 | 0.95 | 0.94 | 0.91 | 0.90 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素 | Al | B | Be | C | Cl | F | Li |
| x的数值 | 1.5 | 2.0 | 1.5 | 2.5 | 2.8 | 4.0 | 1.0 |
| 元素 | Mg | Na | O | P | S | Si | |
| x的数值 | 1.2 | 0.9 | 3.5 | 2.1 | 2.5 | 1.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子化合物中一定含有离子键 | |
| B. | 单质分子中均不存在化学键 | |
| C. | 含活泼金属元素的化合物一定不是共价化合 | |
| D. | 含有共价键的化合物一定是共价化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
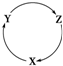 下表各组物质中,不满足下图物质一步转化关系的选项是( )
下表各组物质中,不满足下图物质一步转化关系的选项是( )| 选项 | X | Y | Z |
| A | NO2 | HNO3 | NO |
| B | Cu | CuSO4 | Cu(OH)2 |
| C | Al2O3 | NaAlO2 | Al(OH)3 |
| D | SiO2 | Na2SiO3 | H2SiO3 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
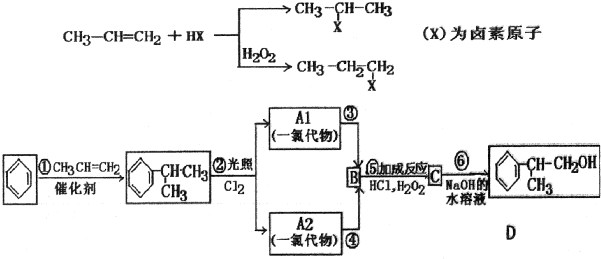
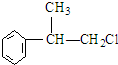 、,
、,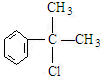 ;
; ,C的结构简式:
,C的结构简式: ;
; +NaOH$→_{△}^{水}$
+NaOH$→_{△}^{水}$ +NaCl;
+NaCl;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素代号 | A | B | C | D | E |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.099 | 0.074 |
| 主要化合价 | +2 | +3 | +6,-2 | -1 | -2 |
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
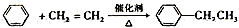

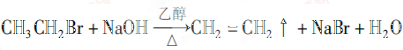 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com