
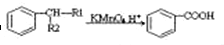
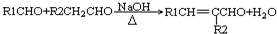 (-R1、-R2表示氢原子或烃基)
(-R1、-R2表示氢原子或烃基)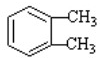 ,D的结构简式是CH3CH=CHCHO,D→E的反应类型加成(还原)反应;
,D的结构简式是CH3CH=CHCHO,D→E的反应类型加成(还原)反应;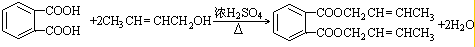 ;
; ;
;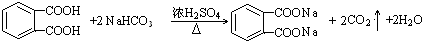 .
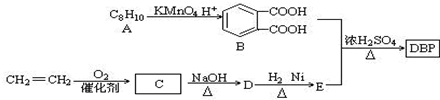
. 分析 结合已知信息①,由B可推断A的结构简式为: ;由信息②可知D的结构简式为:CH3CH=CHCHO,D和H2 1:1反应生成E,则E为CH3CH=CHCH2OH,C的结构简式为:CH3CHO;B与E的反应为酯化反应,生成的DBP的结构简式为;
;由信息②可知D的结构简式为:CH3CH=CHCHO,D和H2 1:1反应生成E,则E为CH3CH=CHCH2OH,C的结构简式为:CH3CHO;B与E的反应为酯化反应,生成的DBP的结构简式为; ,根据以上分析并有机物的结构和性质进行解答.
,根据以上分析并有机物的结构和性质进行解答.
解答 解:由B可知A应为 ,甲基被氧化为羧基;结合信息②可知D为CH3CH=CHCHO,D和H2 1:1反应生成E,则E的结构简式为:CH3CH=CHCH2OH,B与E的反应为酯化反应,DBP为;
,甲基被氧化为羧基;结合信息②可知D为CH3CH=CHCHO,D和H2 1:1反应生成E,则E的结构简式为:CH3CH=CHCH2OH,B与E的反应为酯化反应,DBP为; ,
,
(1)通过以上分析知,A的结构简式为: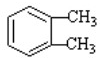 ,D的结构简式为CH3CH=CHCHO;D和氢气发生加成反应生成E,所以该反应类型为加成反应,也属于还原反应,
,D的结构简式为CH3CH=CHCHO;D和氢气发生加成反应生成E,所以该反应类型为加成反应,也属于还原反应,
故答案为: ;CH3CH=CHCHO;加成(还原)反应;
;CH3CH=CHCHO;加成(还原)反应;
(2)E的结构简式为:CH3CH=CHCH2OH,其分子中还原碳碳双键和羟基;根据分析可知DBP的结构简式为: ,其分子式为:C16H18O4,
,其分子式为:C16H18O4,
故答案为:碳碳双键、羟基;C16H18O4;
(3)E的结构简式为:CH3CH=CHCH2OH,与邻苯二甲酸发生酯化反应,反应的方程式为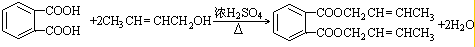 ,
,
故答案为: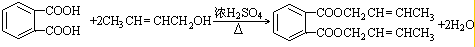 ;
;
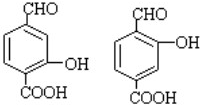
(4)①能和NaHCO3溶液反应生成CO2说明含有羧基;③能使FeC13溶液发生显色反应说明含有酚羟基;②能发生银镜反应说明含有醛基;④苯环上含碳基团处于对位,则符合条件的B的同分异构体有: ,
,
故答案为: ;
;
(5)B与碳酸氢钠溶液反应的方程式为;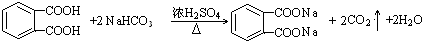 ,
,
故答案为: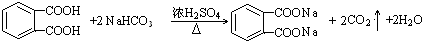 .
.
点评 本题考查有机合成,题目难度中等,明确合成原理、灵活运用已知信息为解答关键,注意掌握常见有机物结构与性质,(4)为易错点,注意合理把握同分异构体的概念及书写原则,试题培养了学生的分析、理解能力及灵活运用所学知识的能力.


科目:高中化学 来源: 题型:选择题
| A. | 1392m3 | B. | 1740m3 | C. | 1920m3 | D. | 2304m3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:X>Y>Z | B. | 非金属性:X>Y>Z | ||
| C. | 气态氢化物的稳定性:ZH3>H2Y>HX | D. | 原子序数:Z>Y>X |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验室制取乙烯时用酒精灯加热,使反应体系的温度迅速上升到170℃是为了加快反应速率 | |
| B. | 提纯苯甲酸的实验中,粗苯甲酸全部溶解后不用再向烧杯中加入少量蒸馏水 | |
| C. | 实验室用已知浓度的醋酸溶液滴定未知浓度的氢氧化钠溶液时,选用酚酞作指示剂比选用甲基橙作指示剂时带来的误差要小一些 | |
| D. | 要检验某混合气体中含有乙烯,可以将气体直接通入到酸性高锰酸钾溶液中,若紫色褪去,则说明含有乙烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 实验现象 | 解释与结论 |
| A | 向某溶液中加入BaCl2溶液 | 有白色沉淀产生 | 生成了难溶于水的BaSO4,该溶液中一定含有SO42- |
| B | 向甲苯中滴入少量浓溴水,振荡,静置 | 溶液分层,上层呈橙红色,下层几乎无色 | 甲苯和溴水发生取代反应,使溴水褪色 |
| C | 向鸡蛋清溶液中,加入饱和(NH4)2SO4溶液 | 有白色沉淀产生 | 蛋白质发生了盐析 |
| D | 向蔗糖中加入浓硫酸 | 变黑,放热,体积膨胀,放出刺激性气体 | 浓硫酸具有吸水性和强氧化性,反应中生成C、SO2和CO2等 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 现象 | 结论 |
| A | 淀粉溶液中加稀硫酸,加热片刻,滴加银氨溶液,再水浴加热 | 无银镜生成 | 淀粉未发生水解 |
| B | 将一铝箔放在酒精灯外焰上灼烧 | 铝箔熔化但不滴落 | 铝箔表面生成致密的Al2O3薄膜,且Al2O3熔点高于Al |
| C | 铜放入稀硫酸中,再加入硝酸钠固体 | 开始无明显现象,后溶液变蓝,有明显的气泡放出,铜溶解 | 硝酸钠可以加快铜与稀硫酸的反应速率 |
| D | 向2 mL 0.1 mol/L Na2S溶液中滴几滴0.1 mol/L ZnSO4溶液;再加入几滴0.1 mol/L CuSO4溶液 | 先生成白色沉淀,后生成黑色沉淀 | 溶度积(Ksp):ZnS>CuS |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲苯能使酸性高锰酸钾溶液褪色,说明甲苯中含有碳碳双键 | |
| B. | 乙烯能发生加成反应,因而乙烯能在一定条件下聚合生成高分子化合物 | |
| C. | 有机物的水溶液一定不能导电 | |
| D. | 通常情况下呈气态的烃含有的碳原子一定不多于四个 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 92.1% | B. | 84.6% | C. | 92.3% | D. | 84.2% |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com