
【题目】实验室制取氯气,将多余的氯气用100 mL 1.7mol/L的NaOH溶液完全吸收。对吸收后的溶液进行分析化验,测知c(OH-)=0.1mol/L (不考虑反应前后溶液的体积变化) 。ClO-和ClO3-的物质的量浓度之比为5∶1。请回答:
(1)吸收氯气消耗的NaOH的物质的量为_______________mol。
(2)被氧化的氯气的物质的量为_______________mol,被还原的氯气的物质的量为 _______________mol。
(3)若采用二氧化锰和浓盐酸共热的方法制氯气,制备尾气中的氯气所消耗的二氧化锰的质量为_______________g。
【答案】0.16 0.03 0.05 6.96
【解析】
根据氯气的尾气吸收的化学方程式8Cl2+16NaOH=5NaClO+NaClO3+10NaCl+8H2O和实验室制氯气的化学方程式MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O进行计算。
MnCl2+Cl2↑+2H2O进行计算。
⑴反应前NaOH的物质的量为:0.1 L×1.7 mol/L = 0.17 mol
反应后NaOH的物质的量为:0.1 L×0.1 mol/L = 0.01 mol
消耗的NaOH物质的量为:0.16 mol
⑵根据ClO-和ClO3-的物质的量浓度之比为5∶1可写出反应方程式:8Cl2+16NaOH=5NaClO+NaClO3+10NaCl+8H2O,
则反应掉的氯气n(Cl2)=![]() n(NaOH)=
n(NaOH)=![]() ×0.16mol=0.08mol,
×0.16mol=0.08mol,
其中被氧化的氯气即化合价升高的为![]() ,即为
,即为![]() ×0.08mol=0.03mol,
×0.08mol=0.03mol,
则被还原的氯气即为0.08-0.03=0.05mol;
⑶ 由(2)可知,尾气中的氯气为0.08mol,根据化学方程式:MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O可知,消耗二氧化锰的物质的量和氯气的物质的量相等,即n(MnO2)=0.08mol,所以m(MnO2) =87g×0.08mol/1mol=6.96 g。
MnCl2+Cl2↑+2H2O可知,消耗二氧化锰的物质的量和氯气的物质的量相等,即n(MnO2)=0.08mol,所以m(MnO2) =87g×0.08mol/1mol=6.96 g。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】有甲乙两位同学均想利用原电池反应检测金属的活动性顺序,两人均使用镁片和铝片作电极,但甲同学将电极放入 6mol/L 的硫酸溶液,乙同学将电极放入 6mol/L 的氢氧化钠溶液中,如图所示:
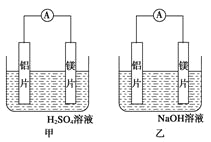
(1)写出甲电池中正极的电极反应式___________________ ;
(2)写出乙池中负极的电极反应式: 负极:_____ 总反应的离子方程式:_________
(3)如果甲与乙同学均认为“构成原电池的电极材料如果都是金 属,则构成负极材料的金属活泼
,则甲会判断出_____活动性更强,而乙会判断出_____活动性更强(填名称)
(4)由此实验,可得到如下哪些正确结论(_____)
a. 利用原电池反应判断金属活动性顺序时应注意选择合适的介质
b. 镁的金属性不一定比铝的强
c. 该实验说明金属活动性顺序表已过时,已没有利用价值
d. 该实验说明化学研究对象复杂,反应受条件影响较大,因此应具体问题具体分析
(5)上述实验也反过来证明了“直接利用金属活动性顺序表判断原电池中的正负极”这种做法__填 “可靠”或“不可靠”)。如不可靠,请你提出另一个判断原电池正负极的可行实验方案_______________ (如 可靠,可不填)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某海水中主要离子的含量如下表,现利用“电渗析法”进行淡化,技术原理如图所示(两端为惰性电极,阳膜只允许阳离子通过,阴膜只允许阴离子通过)。下列有关说法错误的是( )
离子 |
|
|
|
|
|
|
|
含量 | 9360 | 83 | 200 | 1100 | 16000 | 1200 | 118 |
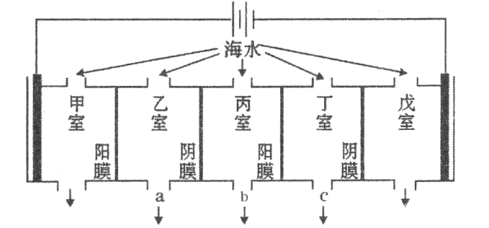
A.甲室的电极反应式为:![]()
B.乙室和丁室中部分离子的浓度增大,淡水的出口为b
C.当戊室收集到![]() (标准状况)气体时,通过甲室阳膜的离子的物质的量一定为
(标准状况)气体时,通过甲室阳膜的离子的物质的量一定为![]()
D.淡化过程中易在戊室形成水垢
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在反应A(g)+3B(g)=2C(g)中,若以物质A表示的该反应的化学反应速率为0.2 mol·L1·min1,则以物质B表示此反应的化学反应速率为________mol·L1·min1。
(2)在2 L的密闭容器中,充入2 mol N2和3 mol H2,在一定条件下发生反应,3 s后测得N2为1.9 mol,则以H2的浓度变化表示的反应速率为____________________________。
(3)将10 mol A和5 mol B放入容积为10 L的密闭容器中,某温度下发生反应:3A(g)+B(g) ![]() 2C(g),在最初2 s内,消耗A的平均速率为0.06 mol·L1·s1,则在2 s时,容器中有______ mol A,此时C的物质的量浓度为________。
2C(g),在最初2 s内,消耗A的平均速率为0.06 mol·L1·s1,则在2 s时,容器中有______ mol A,此时C的物质的量浓度为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,将充满NO2和O2的试管倒立于水槽中,充分反应后,剩余气体的体积为原混合气体体积的![]() ,则原混合气体中NO2和O2的体积之比是
,则原混合气体中NO2和O2的体积之比是
A.8:1B.7:3C.1:7D.4:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是(NA表示阿伏加德罗常数的值)( )
A. 物质的量浓度为0.5mol/L的MgCl2溶液中,含有Cl- 个数为NA
B. 标准状况下,18 g H2O所占的体积约是22.4 L
C. 32 g O2在标准状况下所占的体积约为22.4 L
D. 2.4g金属镁变为镁离子时失去的电子数为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,甲、乙两池电极材料都是铁棒和碳棒,请回答下列问题:
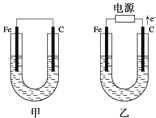
(1)若两池中电解质溶液均为CuSO4溶液,则反应一段时间后:
①有红色物质析出的是甲池中的___棒,乙池中的___棒。
②乙池中阳极的电极反应式是___。
(2)若两池中电解质溶液均为饱和NaCl溶液:
①写出乙池中总反应的离子方程式___。
②甲池中碳极上电极反应式是___,乙池碳极上电极反应属于___(填“氧化反应”或“还原反应”)。
③将湿润的KI淀粉试纸放在乙池碳极附近,发现试纸变蓝,反应的化学方程式为___。
④若乙池转移0.02mole﹣后停止实验,池中电解质溶液体积是200mL,则溶液混合均匀后的pH=___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X、Y、Z、W为短周期主族元素,在元素周期表中的相对位置如下图所示,其中Z元素原子之间通常形成Z2分子。下列说法不正确的是( )
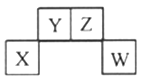
A. X元素的单质既能与强酸反应也能与强碱反应
B. Y元素形成的氢化物在常温下不一定为气体
C. W元素的最高价氧化物对应水化物一定为强酸
D. 由Y、Z、W三种元素形成的二元化合物中只含共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种用于隐形眼镜材料的聚合物片段如下:

下列关于该高分子说法正确的是
A. 结构简式为:
B. 氢键对该高分子的性能没有影响
C. 完全水解得到的高分子有机物,含有官能团羧基和碳碳双键
D. 完全水解得到的小分子有机物,具有4种不同化学环境的氢原子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com