
| A. | 称取7.6g硫酸铜,加入500 mL的水 | B. | 称取8.0g硫酸铜,配成500mL溶液 | ||
| C. | 称取12.0g胆矾,配成500mL溶液 | D. | 称取12.5g胆矾,加入500mL水 |
分析 需要480mL溶液,实际只能配置500mL,根据n=c×V计算溶质的物质的量,配制硫酸铜溶液可以用硫酸铜,也可以用胆矾,根据m=n×M计算各自质量,配制溶液时注意水的体积不等于溶液的体积.
解答 解:需要480mL溶液,实际只能配置500mL,配制500mL 0.100mol•L-1的CuSO4溶液,溶质的物质的量为:n=c×V=0.5L×0.100mol/L=0.0500mol,需要溶质的质量为:m(CuSO4)=0.05mol×160g/mol=8.0g,
或m(CuSO4•5H20)=0.05mol×250g/mol=12.5g.
A.应称取8.0gCuSO4,配成500mL溶液,水的体积不等于溶液的体积,故A错误;
B.称取8.0gCuSO4,配成500mL溶液,溶液的浓度为 0.100mol•L-1,故B正确;
C.称取12.5g胆矾,配成500mL溶液,故C错误;
D.称取12.5g胆矾,配成500mL溶液,水的体积不等于溶液的体积,故D错误.
故选B.
点评 本题考查物质的量浓度的相关计算,题目难度不大,注意两点,一是配制硫酸铜溶液可以用硫酸铜,也可以用胆矾,二是注意水的体积不等于溶液的体积.


科目:高中化学 来源: 题型:选择题
| A. | Cl2+H2O=HCl+HClO | B. | 2Na2O2+2H2O=4NaOH+O2? | ||
| C. | 2F2+2H2O=4HF+O2? | D. | 2Na+4H2O=2NaOH+H2? |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| A | B | C | D | E | F | |
| 主要化合价 | -1 | -3+5 | -2+6 | -1+7 | +2 | +1+2 |
| 原子半径nm | 0.071 | 0.11 | 0.102 | 0.099 | 0.197 | 0.117 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
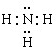 ,B的结构式为
,B的结构式为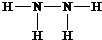 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | a | B. | b | C. | c | D. | d |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
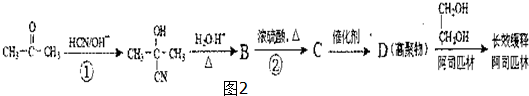
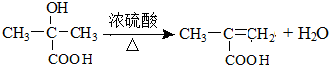
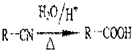 ,回答问题:
,回答问题: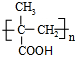 .
. .
.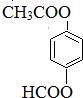 (只写一种).
(只写一种).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
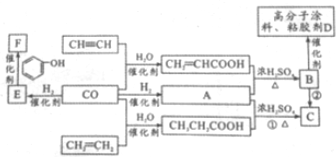
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com