
 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案 一课一练一本通系列答案
一课一练一本通系列答案 浙江之星学业水平测试系列答案
浙江之星学业水平测试系列答案科目:高中化学 来源: 题型:
| A、铜与硫酸亚铁反应 Cu+Fe2+═Cu2++Fe |
| B、澄清的石灰水跟盐酸反应 H++OH-═H2O |
| C、碳酸钡溶于醋酸BaCO3+2H+═Ba2++H2O+CO2↑ |
| D、金属钠跟水反应Na+H2O═Na++OH-+H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验编号 | NaOH溶液的浓度 (mol/L) | 滴定完成时,NaOH溶液滴入的体积(mL) | 待测盐酸溶液的体积 (mL) |
| 1 | 0.10 | 22.62 | 20.00 |
| 2 | 0.10 | 22.72 | 20.00 |
| 3 | 0.10 | 22.80 | 20.00 |

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
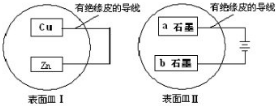
| A、表面皿Ⅰ和表面皿Ⅱ中溶液pH不断升高 |
| B、锌片和石墨a均发生氧化反应.铜片和石墨a上均有H2放出 |
| C、表面皿Ⅰ溶液中c(Zn2+)浓度增大 |
| D、石墨b附近滴加酚酞变红 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、④>③=②>① |
| B、④<③=②<① |
| C、①>②>③>④ |
| D、④>③>②>① |
查看答案和解析>>
科目:高中化学 来源: 题型:
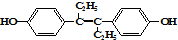 下列叙述中正确的是( )
下列叙述中正确的是( )| A、该有机物分子中,最多可能有18个碳原子共平面 |
| B、分子中有7个碳碳双键,可以与氢气1:7加成 |
| C、该分子对称性好,所以没有顺反异构 |
| D、该分子中有2个H,2个O,6个C共直线 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、进行中和滴定时,直接向刚洗净的锥形瓶中加待测液 |
| B、滴定未知浓度的盐酸所用的0.5mol?L-1 NaOH溶液时,用甲基橙为指示剂,在配制标准溶液时因与空气接触吸收了少量的CO2 |
| C、用标准NaOH溶液滴定未知浓度的稀H2SO4时,用酚酞作指示剂 |
| D、往用蒸馏水洗净的滴定管中直接加入待测液,再注入锥形瓶中 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| 阳离子 | Fe3+ | Fe2+ | Mg2+ | Al3+ | Cu2+ | Cr3+ |
| 开始沉淀时的pH | 1.9 | 7.0 | -- | -- | 4.7 | -- |
| 沉淀完全时的pH | 3.2 | 9.0 | 11.1 | 8 | 6.7 | 9 (>9溶解) |
| +6 |
| Cr |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com