
 ,写出HFO的结构式H-O-F.
,写出HFO的结构式H-O-F. 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | ①④ | B. | ②③ | C. | ①③ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有AgBr沉淀生成 | B. | AgCl和AgBr沉淀等量生成 | ||
| C. | AgCl沉淀多于AgBr沉淀 | D. | AgCl沉淀少于AgBr沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 福岛核电站泄露的放射性物质131I与127I互为同位素,化学性质几乎相同 | |
| B. | 电子云是处于一定空间运动状态的电子在原子核外空间的概率密度分布的形象化描述 | |
| C. | 除去SO2中混有的少量HCl,使气体通过盛有饱和NaHSO3溶液的洗气瓶 | |
| D. | 为了证明氢氧化钠是离子化合物,可在瓷坩埚中将氢氧化钠固体熔化后测其导电性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
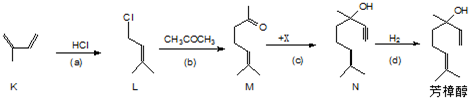
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,合成E和高分子树脂N的路线如图1所示:
,合成E和高分子树脂N的路线如图1所示: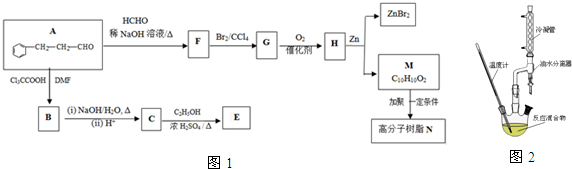
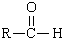 $→_{DMF}^{CI_{3}CCOOH}$
$→_{DMF}^{CI_{3}CCOOH}$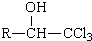 $→_{(ii)H+}^{(i)NaOH/H_{2}O,△}$
$→_{(ii)H+}^{(i)NaOH/H_{2}O,△}$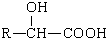
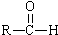 +
+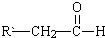 $→_{△}^{稀NaOH溶液}$
$→_{△}^{稀NaOH溶液}$
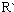 表示烃基或氢原子)
表示烃基或氢原子)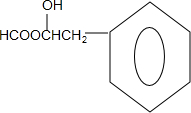
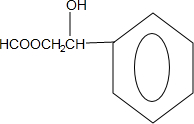 .
.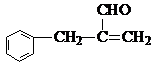 ;N的结构简式为
;N的结构简式为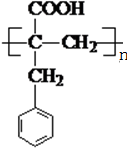 .
.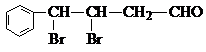 ,下列有关X的说法正确的是ac(填标号).
,下列有关X的说法正确的是ac(填标号).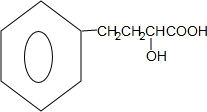 $\stackrel{催化剂}{?}$
$\stackrel{催化剂}{?}$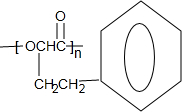 +nH2O.
+nH2O.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
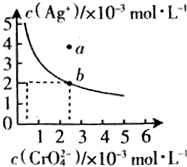 水中的沉淀溶解平衡曲线如图所示. 该温度下.下列说法正确的是AD.
水中的沉淀溶解平衡曲线如图所示. 该温度下.下列说法正确的是AD.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
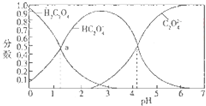
| A. | pH=5的溶液中c(C2O42-)>c(HC2O4-) | |
| B. | NaHC2O4溶液中:c(OH-)+c(C2O42-)=c(H+)+c(H2C2O4) | |
| C. | 向NaHC2O4溶液中加强酸至pH与a点对应时,溶液中2c(Na+)=c(HC2O4-)+c(H2C2O4) | |
| D. | 为使溶液中c(HC2O4-)尽可能多一些,溶液的pH最好控制在2.7左右 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com