
分析 (1)c(B-)>c(A+)>c(H+)>c(OH-),溶液显示酸性,为强酸弱碱盐;
(2)若为强碱弱酸盐或氨水和氯化铵的混合物,溶液显示碱性,该关系正确;
(3)溶液中一定满足电荷守恒,该关系式中违反了电荷守恒.
解答 解:(1)若为强酸弱碱盐溶液或醋酸和醋酸钠的混合物,则离子浓度c(B-)>c(A+)>c(H+)>c(OH-)正确,如:NH4Cl或AgNO3或NH4NO3或CH3COOH和CH3COONa,
故答案为:正确,NH4Cl(AgNO3或NH4NO3或CH3COOH和CH3COONa);
(2)c(A+)>c(B-)>c(OH-)>c(H+)中氢氧根离子浓度大于氢离子,溶液呈碱性,c(A+)>c(B-),若为强碱弱酸盐(如醋酸钠)或NH3•H2O和NH4Cl的溶液中满足该关系,
故答案为:正确,CH3COONa(或NH3•H2O和NH4Cl);
(3)关系式c(H+)>c(B-)>c(A+)>c(OH-)中:c(H+)+c(A+)>c(B-)+c(OH-),违背了电荷守恒,所以该关系一定错误,
故答案为:不正确,因c(H+)+c(A+)>c(B-)+c(OH-),违背了电荷守恒.
点评 本题考查了离子浓度大小比较,题目难度中等,明确电荷守恒、物料守恒及盐的水解原理为解答关键,试题侧重考查学生的分析、理解能力及灵活应用基础知识的能力.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题

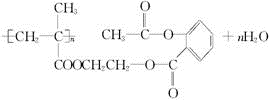
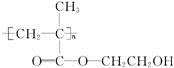 .
.
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Q2-Q1 | B. | Q1+Q2 | C. | Q1-Q2 | D. | -Q1-Q2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 序号 | 实验目的 | 方法及操作 |
| ① | 比较水和乙醇中羟基氢的活泼性强弱 | 用金属钠分别与水和乙醇反应 |
| ② | 鉴别二甲醚和乙醇 | 利用质谱法 |
| ③ | 检验乙醇在浓硫酸催化下的消去产物 | 将产物通入酸性KMnO4溶液 |
| ④ | 检验溴乙烷中的溴元素 | 将少量溴乙烷与NaOH溶液混合共热,充分反应并冷却后,再滴加AgNO3溶液 |
| ⑤ | 鉴别苯、四氯化碳、丙醛 | 分别滴加溴水 |
| A. | ①⑤ | B. | ②③ | C. | ①④⑤ | D. | ②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④ | B. | ③④ | C. | ②③ | D. | ①② |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol•L-1CH3COONa溶液与0.1 mol•L-1HCl溶液等体积混合:c(Na+)=c(Cl-)>c(CH3COO-)>c(OH-) | |
| B. | 0.1 mol•L-1NH4Cl溶液与0.1 mol•L-1氨水等体积混合(pH>7):c(NH3•H2O)>c(NH4+)>c(Cl-)>c(OH-) | |
| C. | 0.1 mol•L-1Na2CO3溶液与0.1 mol•L-1NaHCO3溶液等体积混合:$\frac{2}{3}$c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) | |
| D. | 0.1 mol•L-1Na2C2O4溶液与0.1 mol•L-1HCl溶液等体积混合(H2C2O4为二元弱酸):2c(C2O42-)+c(HC2O4-)+c(OH-)+c(Cl-)=c(Na+)+c(H+). |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 上式中的X为S4O62- | |
| B. | 该反应中的还原剂为Fe2+和S2O32- | |
| C. | 当3 mol Fe2+被氧化时,被Fe2+还原的O2的物质的量为1 mol | |
| D. | 当生成1 mol Fe3O4时,转移电子的物质的量为4 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com