

分析 (1)微热A装置中的玻璃管,通过F中是否有气泡及导管中是否形成水柱进行判断装置的气密性;该反应中生成的CO有毒,需要使用尾气吸收装置;
(2)加热草酸亚铁可得到CO、CO2和FeO,据此写出反应的化学方程式;
(3)E出在加热条件下反应,若CO纯度不足会发生爆炸,所以先加热A将装置中空气排净,再加热E;装置B中的氢氧化钡溶液用于检验并除去二氧化碳,装置C用于检验二氧化碳是否除尽,避免干扰CO的检验;装置D盛放浓硫酸,用于干燥CO气体;装置C澄清石灰水没有变浑浊,证明二氧化碳已经除尽,若装置F中澄清石灰水变浑浊,则证明混合气体中含有CO;
(4)将几滴KSCN溶液加入到该溶液中,结果发现溶液变红色,说明溶液中含有铁离子,可能是生成的氧化亚铁被氧气氧化,也可能是原草酸亚铁中含有+3价的铁的化合物;若验证假设①的正确性,实验前用氮气将装置中的空气排净即可,据此设计方案.
解答 解:(1)用酒精灯微热A处的硬质玻璃管,若装置气密性良好,则会观察到F处有气泡产生,停止加热后F中的导管内有一端水柱;加热草酸亚铁可得到CO、CO2和FeO,CO是一种有毒气体,多余的气体需要不能直接排放,该装置中缺少尾气处理装置,
故答案为:用酒精灯微热A处的硬质玻璃管,观察到F处有气泡产生,停止加热后观察到F中的导管内有一端水柱;缺少尾气处理装置;
(2)加热草酸亚铁可得到CO、CO2和FeO,反应的化学方程式为:FeC2O4$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+CO↑+FeO,
故答案为:FeC2O4$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+CO↑+FeO;
(3)E的反应需要加热,若CO纯度不足会发生爆炸现象,所以应该先加热A将装置中空气排净,再加热E,顺序不能颠倒;
二氧化碳能够与氢氧化钡反应生成白色沉淀,所以装置B中的氢氧化钡溶液用于检验并除去二氧化碳;
装置F用于检验CO被氧化后生成的二氧化碳,所以原气体中的二氧化碳必须除尽,所以装置C用于检验二氧化碳是否除尽,避免干扰CO的检验;
装置E中用CO与CuO在加热条件下反应,气体必须是干燥的,所以装置D盛放浓硫酸,用于干燥CO气体;
当装置C澄清石灰水没有变浑浊时,证明原混合气体中的二氧化碳已经除尽,若装置F中澄清石灰水还变浑浊,则证明混合气体中含有CO,
故答案为:先加热A,后加热E;检验并除去CO2;检验CO2是否除尽;浓硫酸;C中无明显现象而F中石灰水变浑浊;
(4)取适量的A中已充分分解后的固体溶于已除去溶解氧的纯稀硫酸中,将几滴KSCN溶液加入到该溶液中,结果发现溶液变红色,说明溶液中含有铁离子,亚铁离子容易被氧化,可能是生成的氧化亚铁被装置中的氧气氧化,也可能是原草酸亚铁样品中混有+3价的铁的化合物;
若验证假设①的正确性,实验前用氮气将装置中的空气排净即可,改进方法为:将A中硬质玻璃管的橡皮塞改为连接有导管及止水夹的橡皮塞,加热A处前先向装置内通入一段时间的N2,
故答案为:草酸亚铁中混有+3价的铁的化合物;将A中硬质玻璃管的橡皮塞改为连接有导管及止水夹的橡皮塞,加热A处前先向装置内通入一段时间的N2.
点评 本题考查了探究物质组成及性质实验方案的设计,题目难度中等,明确实验目的及化学实验基本操作方法为解答关键,注意掌握性质实验方案的设计方法,试题充分考查了学生的分析、理解能力及化学实验能力.


 文敬图书课时先锋系列答案
文敬图书课时先锋系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 煤经分馏得到了煤焦油,从中可分离出苯、甲苯、二甲苯等有机化合物 | |
| B. | 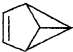 的一氯代物有3种 的一氯代物有3种 | |
| C. | 若两种二肽互为同分异构体,则二者的水解产物一定不相同 | |
| D. | 木糖醇(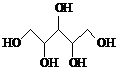 )和葡萄糖( )和葡萄糖(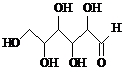 ),互为同系物,均属于糖类 ),互为同系物,均属于糖类 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
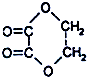 ④CH3OCOCH3 ⑤(COOC2H5)2 ⑥C2H5OCOOC2H5 ⑦CH3-COCH2O-CH3 ⑧CH3OCOOH ⑨HCOOCH3.
④CH3OCOCH3 ⑤(COOC2H5)2 ⑥C2H5OCOOC2H5 ⑦CH3-COCH2O-CH3 ⑧CH3OCOOH ⑨HCOOCH3.| A. | ①②⑤ | B. | ①②⑦ | C. | ②③⑧ | D. | ④⑥⑨ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子晶体中分子间作用力越大,分子越稳定 | |
| B. | 硫酸氢钠溶于水时只破坏离子键 | |
| C. | 含有阳离子的晶体中一定有阴离子 | |
| D. | 1 mol二氧化硅晶体含4 mol Si-O键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | S2-的结构示意图: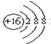 | B. | 氯气的电子式:Cl:Cl | ||
| C. | 氧-18的原子符号:${\;}_{8}^{18}$O | D. | CO2分子的结构式:O=C=O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用食盐腌制食物 | B. | 用盐酸除去铁钉表面的铁锈 | ||
| C. | 用液氨作制冷剂 | D. | 用漂粉精消毒游泳池中的水 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com