
| A. | 氢氧化铝能溶于强碱溶液 | B. | 铝片能与盐酸反应生成氢气 | ||
| C. | 氯化铝溶液显酸性 | D. | 铝能发生铝热反应 |
分析 一般的金属氢氧化物都只能溶于酸中,氢氧化铝溶于碱中,即验证了铝与其它金属不同,又验证了它的非金属性,据此分析解答.
解答 解:A.常见的金属氢氧化物都只能溶于酸中,非金属(如Si)或是非金属氧化物一般会溶解在碱中这里氢氧化铝溶于强碱溶液中,可以表明金属铝和其他金属不同,同时还表现了金属铝的非金属性一面,故A正确;
B.较活泼金属、活泼金属都能和盐酸反应生成氢气,所以铝片与稀盐酸反应生成氢气,体现铝的金属性,故B错误;
C.氯化铝溶液中铝离子水解显示酸性,证明氢氧化铝是弱碱,不能证明金属铝的非金属性一面,故C错误;
D.铝热反应证明的是金属可以置换金属,只能证明金属铝的金属性方面,故D错误;
故选A.
点评 本题考查元素化合物性质,为高频考点,明确物质性质及物质性质差异性是解本题关键,注意金属性、非金属性判断方法,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:多选题
| A. | 10Fe2++8I-+4Br-+11Cl2→10Fe3++4I2+2Br2+22Cl- | |
| B. | 2Fe2++2I-+2Cl2→2Fe3++I2+4Cl- | |
| C. | 6Fe2++4I-+5Cl2→6Fe3++2I2+10Cl- | |
| D. | 6Fe2++2I-+6Br-+7Cl2→6Fe3++I2+3Br2+14Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该电池又称纽扣电池,是可充电池,适用于大电流连续放电 | |
| B. | 该电池属于碱性电池,放电过程中,锌失去电子生成锌离子,向负极移动 | |
| C. | 该电池在放电过程中,正极的pH变大 | |
| D. | 该电池的负极反应式:Zn-2e-=Zn2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子晶体中,可能不存在共价键,但一定存在分子间作用力 | |
| B. | 两种元素组成的分子中一定只有极性键 | |
| C. | 只含共价键的物质,一定是共价化合物 | |
| D. | 氧化还原反应中,一种元素化合价上升,一定有另一种元素化合价下降 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
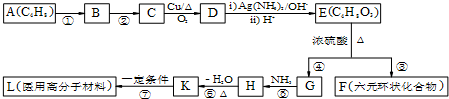
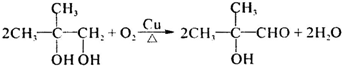
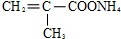 .
.
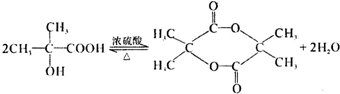
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 剩余的5.44g金属为铁 | B. | 剩余5.44g金属为铜 | ||
| C. | 共生成NO气体 0.03mol | D. | 8.08g金属中铁的质量分数为20.8% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 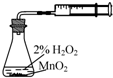 装置可测定化学反应速率 | |
| B. | 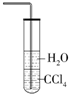 装置可用于吸收氨气,并防止倒吸 | |
| C. |  装置量取8.5 mL的稀硫酸 | |
| D. |  装置可制备氢氧化亚铁并观察其颜色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al3++SO42-+Ba2++3OH-→BaSO4↓+Al(OH)3↓ | |
| B. | Al3++2SO42-+2Ba2++4OH-→BaSO4↓+AlO2- | |
| C. | 2 Al3++3SO42-+3Ba2++6OH-→3BaSO4↓+2Al(OH)3↓ | |
| D. | 4Al3++7SO42-+7Ba2++14OH-→7BaSO4↓+2Al(OH)3↓+2AlO2- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol CO2中含有原子数NA | |
| B. | 1 L 1mol/L的硫酸钠溶液中,所含Na+数为NA | |
| C. | 标准状况下,11.2 L水所含分子数为0.5 NA | |
| D. | 1 mol Fe含有原子数NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com