
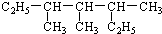 3,3,5-三甲基庚烷
3,3,5-三甲基庚烷分析 (1)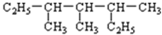 为烷烃,将两个乙基展开后,最长碳链含有7个C,主链为庚烷,编号从两端都可以,然后根据烷烃的命名原则写出其名称;
为烷烃,将两个乙基展开后,最长碳链含有7个C,主链为庚烷,编号从两端都可以,然后根据烷烃的命名原则写出其名称;
(2)炔烃中含有碳碳三键,在相邻的两个C原子之间添加三键,只有一种添加方式;
(3)CH3CH2CH2Cl与NaOH醇溶液共热生成CH3CH2CH2OH、NaCl,据此写出反应的化学方程式.
解答 解:(1)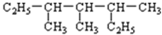 中含有两个乙基的碳链为主链,最长碳链含有7个碳,主链为庚烷,在3、4、5号C各含有1个甲基,该有机物名称为:3,3,5-三甲基庚烷,
中含有两个乙基的碳链为主链,最长碳链含有7个碳,主链为庚烷,在3、4、5号C各含有1个甲基,该有机物名称为:3,3,5-三甲基庚烷,
故答案为:3,3,5-三甲基庚烷;
(2)如果烷烃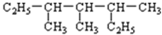 是由炔烃与H2加成得到的,则炔烃的结构简式只有1种,
是由炔烃与H2加成得到的,则炔烃的结构简式只有1种,
故答案为:1;
(3)CH3CH2CH2Cl与NaOH醇溶液共热发生水解反应生成CH3CH2CH2OH、NaCl,反应的化学方程式为:CH3CH2CH2Cl+NaOH$→_{△}^{水}$CH3CH2CH2OH+NaCl,用硝酸酸化,再滴加AgNO3溶液生成白色沉淀,NaCl+AgNO3=AgCl+NaNO3,
故答案为:生成白色沉淀;CH3CH2CH2Cl+NaOH$→_{△}^{水}$CH3CH2CH2OH+NaCl;NaCl+AgNO3=AgCl+NaNO3.
点评 本题考查了有机物的命名、卤代烃的性质等知识,题目难度中等,注意掌握常见有机物的命名原则,明确有机反应原理是解题的关键.


 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案科目:高中化学 来源: 题型:解答题

| 时间/min 温度/℃ | 0 | 10 | 20 | 40 | 50 |
| T1 | 1.2 | 0.9 | 0.7 | 0.4 | 0.4 |
| T2 | 1.2 | 0.8 | 0.56 | 0.5 | 0.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 电离能/kJ•mol-1 | I1 | I2 | I3 | I4 |
| X | 578 | 1817 | 2745 | 11578 |
| Y | 738 | 1451 | 7733 | 10540 |
| Z | 496 | 4562 | 6912 | 9543 |
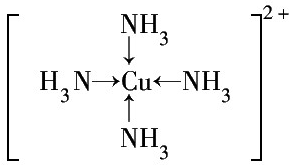 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同浓度的四种溶液:①NH4Cl ②(NH4)2SO4 ③NH4HSO4 ④NH4Al(SO4)2溶液,c(NH4+)浓度的大小关系:②>④>③>① | |
| B. | 一定浓度的NaHS溶液中:c(Na+)+c(OH-)=c(H+)+c(HS-)+2c(H2S) | |
| C. | 若0.1 mol/L NH4Cl溶液pH=5,则其中离子浓度最大与最小的差值为(0.1-10-5)mol/L | |
| D. | 现有四种溶液:①pH=4的H2SO4溶液 ②pH=4的NH4Cl溶液 ③pH=10的氨水 ④pH=10的CH3COONa溶液,其中水电离出的氢离子浓度大小关系为:②=④>③>① |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
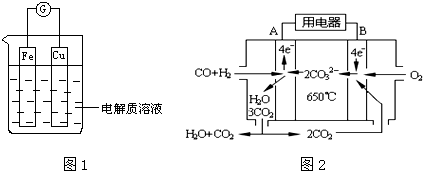
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
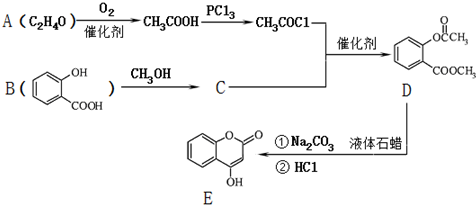
 .
. ;
;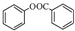 )是一种重要的有机合成中间体.试写出以苯、甲苯为原料制取该化合物的合成路线流程图(无机原料任选).
)是一种重要的有机合成中间体.试写出以苯、甲苯为原料制取该化合物的合成路线流程图(无机原料任选).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com