
可逆反应aA(g)+bB(g)⇌cC(g)+dD(g),取a mol A和b mol B置于V L的容器中,1min后,测得容器内A的浓度为x mol•L﹣1,这时B的浓度为( ﹣)mol•L﹣1,C的浓度为 mol•L﹣1.这段时间内反应的平均速率若以物质A的浓度变化来表示,应为 mol•L﹣1•min﹣1.
考点: 反应速率的定量表示方法.
专题: 化学反应速率专题.
分析: 根据三段法列式计算;根据v=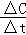 =计算A的化学反应速率;
=计算A的化学反应速率;
解答: 解:开始时,A的物质的量浓度为 mol•L﹣1,1分钟后,测得容器内A的浓度为x mol•L﹣1,反应了(
mol•L﹣1,1分钟后,测得容器内A的浓度为x mol•L﹣1,反应了(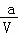 ﹣x)mol•L﹣1,
﹣x)mol•L﹣1,
aA(g)+bB(g)⇌cC(g)+dD(g)
初始时(mol•L﹣1 ) 
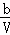 0
0
反应(mol•L﹣1 ) 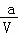 ﹣x
﹣x 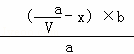

1分钟后(mol•L﹣1 ) x 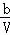 ﹣
﹣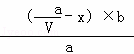

1分钟后,B的浓度为 (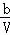 ﹣
﹣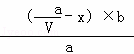 )mol/L,C的浓度为
)mol/L,C的浓度为  mol/L,
mol/L,
A的化学反应速率v= =
=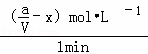 =(
=(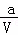 ﹣x) mol•L﹣1•min﹣1
﹣x) mol•L﹣1•min﹣1
故答案为: ﹣
﹣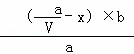 ;
;  ;(
;(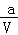 ﹣x) mol•L﹣1•min﹣1;
﹣x) mol•L﹣1•min﹣1;
点评: 本题主要考查了三段法的应用以及化学反应速率的计算,难度不大,根据课本知识即可完成.


科目:高中化学 来源: 题型:
在1L溶液中含有Fe(NO3)3和H2SO4两种溶质,其浓度分别为0.2mol•L﹣1和1.5mol•L﹣1,现向该溶液中加入39.2g铁粉使其充分反应.下列有关说法正确的是()
A. 反应后溶液中Fe3+物质的量为0.8mol
B. 反应后产生13.44L H2(标准状况)
C. 反应后溶液中Fe2+和Fe3+物质的量之和为0.9mol
D. 由于氧化性Fe3+>H+,故反应中先没有气体产生后产生气体
查看答案和解析>>
科目:高中化学 来源: 题型:
某有机物A(C4 H6O5),广泛存在于许多水果中,是一种常用的食品添加剂.该化合物具有如下性质:
i.25℃时,电离常数K1=3.99×10﹣4,K2=5.5×10﹣6
ii.Imol A与足量钠产生1.5mol H2;
ii.分子中核磁共振氢谱显示有5种不同化学环境的氢原子.与A相关的反应流程如下:
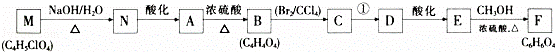
回答下列问题:
(1)A中官能团的名称为 ;B的结构简式为 ,C的系统命名为 _.
(2)A﹣﹣B的反应类型为消去反应;反应①所需的反应条件为 .
(3)写出下列反应的化学方程式:
①M﹣N. ;
②E﹣F. ,
(4)A有多种同分异构体,写出符合下列条件的同分异构体结构简式: .
①能发生水解,生成两种有机物;②水解后产物之间能发生缩聚反应.
查看答案和解析>>
科目:高中化学 来源: 题型:
一定条件下,化学反应2H2+O2═2H2O的能量变化如图所示,则反应的热化学方程式可表示为()

A. H2(g)+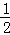 O2(g)═H2O(g)△H=(a+b) kJ•mol﹣1
O2(g)═H2O(g)△H=(a+b) kJ•mol﹣1
B. 2H2(g)+O2(g)═2H2O(g)△H=2(b﹣a) kJ•mol﹣1
C. H2(g)+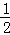 O2(g)═H2O(l)△H=(b+c﹣a) kJ•mol﹣1
O2(g)═H2O(l)△H=(b+c﹣a) kJ•mol﹣1
D. 2H2(g)+O2(g)═2H2O(l)△H=2(a﹣b﹣c) kJ•mol﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
把下列四种X溶液分别加入四个盛有10mL 2mol/L的盐酸的烧杯中,同时加水稀释到50mL,此时X和盐酸缓慢反应.其中反应速率最大的是()
A. 10℃20mL3mol/L的X溶液 B. 20℃30mL2mol/L的X溶液
C. 20℃10mL4mol/L的X溶液 D. 10℃10mL2mol/L的X溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
下列与化学反应能量变化相关的叙述正确的是()
A. 生成物总能量一定低于反应物总能量
B. 等量H2在 O2中完全燃烧,生成H2O(g)与生成H2O(l)放出的能量相同
O2中完全燃烧,生成H2O(g)与生成H2O(l)放出的能量相同
C. 应用盖斯定律,可计算某些难以直接测量的反应焓变
D. 同温同压下,H2(g)+Cl2(g)═2HCl(g)在光照和点燃条件下的△H不同
查看答案和解析>>
科目:高中化学 来源: 题型:
某实验小组用0.50mol/L NaOH溶液和0.50mol/L硫酸溶液进行中和热的测定.
Ⅰ.配制0.50mol/L NaOH溶液
(1)若实验中大约要使用245mL NaOH溶液,至少需要称量NaOH固体 g.
(2)从图中选择称量NaOH固体所需要的仪器是(填字母): .
名称 托盘天平(带砝码) 小烧杯 坩埚钳 玻璃棒 药匙 量筒
仪器 



序号 a b c d e f
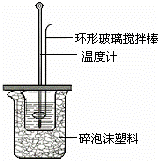
Ⅱ.测定稀硫酸和稀氢氧化钠中和热的实验装置如图所示.
(1)写出该反应的热化学方程式(中和热为57.3kJ/mol): .
(2)取50mL NaOH溶液和30mL硫酸溶液进行实验,实验数据如下表.
①请填写下表中的空白:
温度
实验次数 起始温度t1/℃ 终止温度
t2/℃ 温度差平均值
(t2﹣t1)/℃
H2SO4 NaOH 平均值
1 26.2 26.0 26.1 30.1 4.0
2 27.0 27.4 27.2 33.3
3 25.9 25.9 25.9 29.8
4 26.4 26.2 26.3 30.4
②近似认为0.50mol/L NaOH溶液和0.50mol/L硫酸溶液的密度都是1g/cm3,中和后生成溶液的比热容c=4.18J/(g•℃).则中和热△H= (取小数点后一位).
③上述实验数值结果与57.3kJ/mol有偏差,产生偏差的原因可能是(填字母) .
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度.
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于反应热的说法正确的是()
A. 当△H<0时,表示该反应为吸热反应
B. 已知C(s)+ O2(g)=CO(g)△H=﹣110.5kJ/mol,说明碳的燃烧热为110.5kJ/mol
O2(g)=CO(g)△H=﹣110.5kJ/mol,说明碳的燃烧热为110.5kJ/mol
C. 反应热的大小与反应物所具有的能量和生成物所具有的能量无关
D. 化学反应的反应热只与反应体系的始态和终点状态有关,而与反应的途径无关
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com