
| A. | HI和NaI | B. | CS2和CO2 | C. | Cl2和CCl4 | D. | F2和NaBr |
分析 活泼金属和活泼非金属元素之间易形成离子键,非金属元素之间易形成共价键,同种非金属元素之间易形成非极性键,不同非金属元素之间易形成极性键,据此分析解答.
解答 解:A.HI分子中H-I原子之间只存在共价键,NaI中钠离子和碘离子之间只存在离子键,所以化学键类型不同,故A错误;
B.二硫化碳、二氧化碳分子中都只含共价键,且都是极性键,故B正确;
C.氯气分子中Cl-Cl原子之间只存在非极性键,四氯化碳分子中C-Cl原子之间只存在极性键,故C错误;
D.氟气分子中F-F原子之间只存在非极性键,溴化钠中钠离子和溴离子之间只存在离子键,故D错误;
故选B.
点评 本题考查化学键,侧重考查基本概念,明确物质构成微粒之间作用力即可解答,题目难度不大.


 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案科目:高中化学 来源: 题型:解答题
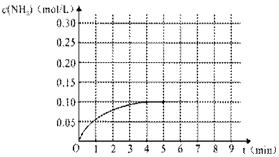 在一容积为2L的密闭容器内加入0.2mol的N2和0.6mol的H2,在一定条件下发生如下反应:N2(g)+3H2(g)?2NH3(g )△H<0,反应中NH3的物质的量浓度的变化的情况如图:
在一容积为2L的密闭容器内加入0.2mol的N2和0.6mol的H2,在一定条件下发生如下反应:N2(g)+3H2(g)?2NH3(g )△H<0,反应中NH3的物质的量浓度的变化的情况如图:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 编号 | 纯净物 | 混合物 | 碱性氧化物 | 非电解质 |
| A | 液氯 | 漂白粉 | Al2O3 | CO |
| B | 纯碱 | 浓硫酸 | CaO | 乙醇 |
| C | 碱石灰 | 王水 | K2O | Cl2 |
| D | 胆矾 | 水玻璃 | Na2O2 | SO2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 被提纯的物质 | 杂质 | 除杂试剂 | 除杂方法 |
| A | CO(g) | CO2(g) | NaOH 溶液、浓 H2SO4 | 洗气 |
| B | NH4Cl (aq) | Fe3+(aq) | NaOH溶液 | 过滤 |
| C | Fe粉 | Al粉 | NaOH溶液 | 过滤 |
| D | Na2CO3(s) | NaHCO3(s) | - | 灼烧 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
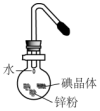 将碘研碎后与锌粉混合于蒸发皿中,然后滴加少量水,可观察到紫红色蒸气产生,此实验被称为“滴水生烟”.关于该实验的下列说法中错误的是( )
将碘研碎后与锌粉混合于蒸发皿中,然后滴加少量水,可观察到紫红色蒸气产生,此实验被称为“滴水生烟”.关于该实验的下列说法中错误的是( )| A. | Zn与I2的反应是放热反应 | B. | 水在该反应中作催化剂 | ||
| C. | 生成的碘化锌为紫红色 | D. | 紫红色的蒸气是碘升华所致 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 呈碱性 | B. | 呈酸性 | C. | 呈中性 | D. | c(H+)=c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 过滤时,用玻璃棒搅动滤纸中的液体 | |
| B. | 做钠的焰色反应实验可用玻璃棒蘸取少量NaCl的浓溶液在无色火焰上灼烧 | |
| C. | 配制溶液过程中定容摇匀后发现液面低于容量瓶的刻度线,再用胶头滴管加水至刻度线 | |
| D. | 用自来水制蒸馏水时,弃去开始馏出的部分液体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠元素性质活泼,不可能应用在电光源上 | |
| B. | 漂白粉的有效成分是Ca(ClO)2 | |
| C. | 浓硝酸可以盛放在铝制容器中 | |
| D. | 向3mL1mol/L的碳酸钠溶液中逐滴滴入稀盐酸,起初并无气体生成 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com