
| A. | ③①④②⑤ | B. | ①③④②⑤ | C. | ③②①④⑤ | D. | ⑤②④①③ |
分析 根据盐类水解的酸碱性和水解程度比较,①(NH4)2SO4、③NH4HSO4、④NH4NO3显酸性,、⑤CH3COONa显碱性,而②NaNO3不水解,显中性,据此分析.
解答 解:①(NH4)2SO4、④NH4NO3水解呈酸性,pH<7;③NH4HSO4电离出H+呈酸性,pH<7;②NaNO3不水解,pH=7;⑤CH3COONa水解呈碱性,pH>7,①、④比较,前者c(NH4+)大,水解生成c(H+)大,pH小,①③比较,后者电离出c(H+)比前者水解出c(H+)大,pH小,所以③①④②⑤,
故选A.
点评 本题考查溶液PH的大小比较,题目难度不大,要考虑盐类的水解程度大小,注意硫酸氢铵中硫酸氢根离子电离出氢离子.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 溶液的酸碱性对生产生活都有重要的影响.
溶液的酸碱性对生产生活都有重要的影响.查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.4 mol•L-1 | B. | 0.3 mol•L-1 | C. | 0.2 mol•L-1 | D. | 0.1 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
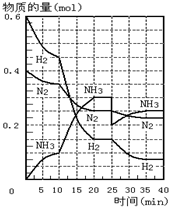 500℃、20MPa时,将H2和N2置于一容积为2L的密闭容器中发生反应.反应过程中H2、N2和NH3物质的量变化如图所示.则下列说法正确的是( )
500℃、20MPa时,将H2和N2置于一容积为2L的密闭容器中发生反应.反应过程中H2、N2和NH3物质的量变化如图所示.则下列说法正确的是( )| A. | ①②③ | B. | ②③④ | C. | ①②④ | D. | ①③④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com