
| A. | x+y<n | B. | 该化学平衡向正方向移动 | ||
| C. | B的转化率增大 | D. | C的体积分数减小 |
分析 xA(g)+yB(g)?zC(g),平衡时测得A的浓度为0.50mol/L,保持温度不变,将容器的容积扩大到原来的两倍,若平衡不移动,A的浓度为0.25mol/L,而再达平衡时,测得A的浓度为0.3mol/L,则说明体积增大(压强减小)化学平衡逆向移动,逆向是气体体积增大的反应,以此来解答.
解答 解:由信息可知,平衡时测得A的浓度为0.50mol/L,保持温度不变,将容器的容积扩大到原来的两倍,若平衡不移动,A的浓度为0.25mol/L,再达到平衡时测得A的浓度为0.3mol/L,体积增大,相当于压强减小,化学平衡逆向移动,逆向是气体体积增大的反应则,
A.由上述分析可知,平衡逆向移动,逆向是气体体积增大的反应,x+y>n,故A错误;
B.由上述分析可知,平衡逆向移动,故B错误;
C.平衡逆向移动,B的转化率减小,故C错误;
D.平衡逆向移动,C的体积分数减小,故D正确;
故选D.
点评 本题考查化学平衡的移动,注意A的浓度变化及体积变化导致的平衡移动是解答本题的关键,熟悉压强对化学平衡的影响即可解答,题目难度中等.


 习题精选系列答案
习题精选系列答案科目:高中化学 来源:2016-2017学年湖北省高二上10月月考化学试卷(解析版) 题型:选择题
下面是生产生活中的常见有机物的分子式?结构(简)式或名称:
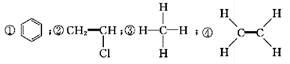
⑤CH3CH2OH;⑥C6H12O6;⑦CH3COOH;⑧硬脂酸甘油酯;⑨蛋白质;⑩聚乙烯。
下列有关说法正确的是( )
A. 能与溴的四氯化碳溶液发生加成反应并使之褪色的有①②④⑩
B. 投入钠能产生H2的有⑤⑦⑧⑨
C. 属于高分子材料的有⑧⑨⑩
D. 含碳量最高?有毒?常温下为液体且点燃时有浓的黑烟的是①
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南省高二上第一次月考化学卷(解析版) 题型:选择题
如图为某化学反应速率一时间图。在t1时刻升高温度或增大压强,都符合图所示变化的 反应是 ( )
反应是 ( )
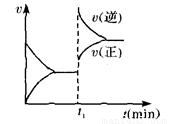
A.4NH3(g)+5O2(g) 4NO(g)+6H2O(g) △H<0
4NO(g)+6H2O(g) △H<0
B.2SO2(g)+O2(g) 2SO3(g) △H<0
2SO3(g) △H<0
C.H2(g)+I2(g) 2HI(g) △H>0
2HI(g) △H>0
D.C(s)+H2O(g) CO(g)+H2(g) △H>0
CO(g)+H2(g) △H>0
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 不变 | B. | 增大 | C. | 减小 | D. | 无法判断 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
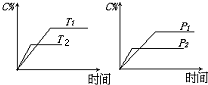 可逆反应mA(s)+nB(g)?eC(g)+fD(g),反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如图,下列叙述正确的是( )
可逆反应mA(s)+nB(g)?eC(g)+fD(g),反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如图,下列叙述正确的是( )| A. | 达平衡后,加入催化剂则C%增大 | |
| B. | 达平衡后,若升温,平衡向逆方向移动 | |
| C. | 化学方程式中n>e+f | |
| D. | 达平衡后,增加A的量有利于平衡向正方向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用加热、称重的方法鉴别Na2CO3固体和NaHCO3固体 | |
| B. | 用焰色反应鉴别NaCl固体和NaOH固体 | |
| C. | 某溶液中滴加盐酸能产生无色气体,该气体能使澄清石灰水变浑浊,则原溶液中一定含CO32- | |
| D. | 向某溶液中加入BaCl2溶液出现白色沉淀,再加入HCl溶液,白色沉淀不溶解,则该溶液中肯定有SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸的电离方程式:H2CO3═2H++CO32- | |
| B. | NaHSO4(溶液)的电离:NaHSO4═Na++H++SO42- | |
| C. | 亚硫酸钠水解的离子方程式:SO32-+2H2O?H2SO3+2OH- | |
| D. | HCO3-的水解方程式为:HCO3-+H2O?CO32-+H3O+ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 碳酸钙与稀盐酸混合:CO32-+2H+=CO2↑+H2O | |
| B. | 硫酸铜溶液与烧碱溶液混合:Cu2++2OH-=Cu(OH)2↓ | |
| C. | 碳酸氢钠与稀盐酸混合:HCO3-+H+=CO2↑+H2O | |
| D. | 铁粉跟稀盐酸反应 2Fe+6H+=2Fe3++3H2↑ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com