

分析 (1)铁发生吸氧腐蚀,铁被氧化生成Fe2+,Fe2+与K3[Fe(CN)6]反应生成蓝色沉淀,正极发生还原反应,氧气得到电子被还原生成OH-;
(2)图2装置发生反应为铜和铁离子的氧化还原反应;
(3)向甲烧杯中滴入几滴酚酞,观察到石墨电极附近首先变红,说明石墨极生成4OH-,应为电解池的阴极,则M为正极,N为负极,乙烧杯为电解硫酸的反应,阳极生成氧气,阴极析出铜,结合电极方程式解答该题.
解答 解:(1)铁发生吸氧腐蚀,铁被氧化生成Fe2+,正极发生还原反应,氧气得到电子被还原生成OH-,电极方程式为O2+4e-+2H2O-═4OH-,
故答案为:氧化;O2+4e-+2H2O-═4OH-;
(2)铜可被Fe3++氧化,发生Cu+2Fe3+=Cu2++2Fe2+,形成原电池反应时,铜为负极,发生氧化反应,石墨为正极,正极反应为Fe3++e-=Fe2+,
故答案为:Cu+2Fe3+=Cu2++2Fe2+;
(3)乙烧杯为电解硫酸的反应,阳极生成氧气,阴极析出铜,
①向甲烧杯中滴入几滴酚酞,观察到石墨电极附近首先变红,说明石墨极生成4OH-,应为电解池的阴极,则M为正极,N为负极,
故答案为:正;
②乙烧杯为电解硫酸的反应,阳极生成氧气,阴极析出铜,电解方程式为2Cu2++2H2O$\frac{\underline{\;电解\;}}{\;}$2Cu+O2↑+4H+,
故答案为:2Cu2++2H2O$\frac{\underline{\;电解\;}}{\;}$2Cu+O2↑+4H+;
③取出Cu电极,洗涤、干燥、称量、电极增重0.64g,则生成Cu的物质的量为$\frac{0.64g}{64g/mol}$=0.01mol,转移的电子的物质的量为0.01mol×2=0.02mol,
甲烧杯中,阳极铁被氧化,阴极产生气体为氢气,
2H2O+2e-═2OH-+H2↑,
2mol 22.4L
0.02mol V
V=$\frac{22.4L×0.02mol}{2mol}$=0.224L,即224ml,
故答案为:224.
点评 本题考查了原电池和电解池原理,为高频考点,侧重于学生的分析、计算能力的考查,根据各个电极上发生的反应再结合转移电子相等来分析解答,难点是(3)计算.


科目:高中化学 来源: 题型:选择题
| A. | 在相同条件下的溶解度:NaHCO3>Na2CO3 | |
| B. | 还原性:I->Br->Cl->F- | |
| C. | 氧化性:F2>Cl2>Br2>I2 | |
| D. | 碳酸氢钠溶液与稀盐酸互滴时两种操作现象相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,反应4Fe(OH)2(s)+2H2O(l)+O2(g)═4Fe(OH)3(s)能自发进行,则△H<0 | |
| B. | 铁片镀锌时,铁片与外电源的正极相连 | |
| C. | 以熔融NaCl为电解质进行电解冶炼钠,熔融体中Na+向阳极移动 | |
| D. | t℃时,恒容密闭容器中反应:NO2(g)+SO2(g)?NO(g)+SO3(g),通入少量O2,$\frac{c(NO)•c(S{O}_{3})}{c(N{O}_{2})•c(S{O}_{2})}$的值及SO2转化率不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 任何情况下,温度都不可能对反应的方向起决定性作用 | |
| B. | pH=4的CH3COOH和NH4Cl溶液中,水的电离程度相同 | |
| C. | 用pH试纸测定溶液pH的正确操作是,将一小条试纸在待测液中蘸一下,取出后放在表面皿上,与标准比色卡对照 | |
| D. | pH=4.5的番茄汁中c(H+)是pH=6.5的牛奶中c(H+)的100倍 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
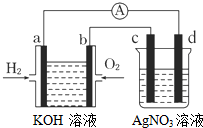 氢氧燃料电池能量转化率高,具有广阔的发展前景.现用氢氧燃料电池进行如图所示的实验(图中所用电极均为惰性电极),下列叙述正确的是( )
氢氧燃料电池能量转化率高,具有广阔的发展前景.现用氢氧燃料电池进行如图所示的实验(图中所用电极均为惰性电极),下列叙述正确的是( )| A. | a电极是负极,OH-移向正极 | |
| B. | b电极的电极反应为:O2+2H2O+4e-═4OH- | |
| C. | 燃料电池中电解质溶液的pH保持不变 | |
| D. | d电极有气体放出 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
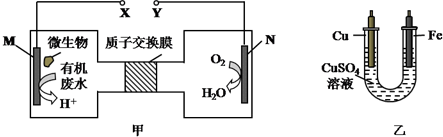
| A. | H十透过质子交换膜由右向左移动 | |
| B. | 铜电极应与X相连接 | |
| C. | M电极反应式:H2NCONH2+H2O-6e-═CO2↑+N2↑+6H+ | |
| D. | 当N电极消耗0.25mol气体时,则铁电极增重16g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
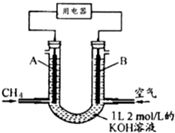 CH4燃料电池,装置示意如图(A、B为多孔性碳棒).持续通入甲烷,在标准状况下,消耗甲烷体积VL.当0<V<44.8L时,电池总反应方程式为CH4+2O2+2KOH=K2CO3+3H2O.
CH4燃料电池,装置示意如图(A、B为多孔性碳棒).持续通入甲烷,在标准状况下,消耗甲烷体积VL.当0<V<44.8L时,电池总反应方程式为CH4+2O2+2KOH=K2CO3+3H2O.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com