
| A. | 2SO2+O2?2SO3△H=-196.6kJ•mol-1 | |
| B. | C(g)+O2(g)=2CO△H=393.5kJ•mol-1 | |
| C. | H2(g)+$\frac{1}{2}$O2(g)=H2O(g)△H=-241.8kJ | |
| D. | 2H2(g)+O2(g)=2H2O(l)△H=-571.6kJ•mol-1 |
分析 A、方程式中物质状态未标注;
B、C燃烧反应生成一氧化碳放热,一氧化碳状态未标注;
C、反应焓变单位是KJ/mol;
D、氢气燃烧放热,并且焓变单位为KJ/mol.
解答 解:A、方程式中物质状态未标注,2SO2(g)+O2(g)═2SO3 (g)△H=-196.6 kJ/mol,故A错误;
B、C燃烧反应生成一氧化碳放热,反应的热化学方程式C(g)+O2(g)═CO(g)△H=-393.5KJ/mol,故B错误;
C、反应焓变单位是KJ/mol,反应的热化学方程式为H2(g)+$\frac{1}{2}$O2(g)=H2O(g)△H=-241.8KJ/mol,故C错误;
D、氢气燃烧放热,并且焓变单位为KJ/mol,反应的热化学方程式为2H2(g)+O2(g)=2H2O(l)△H=-571.6kJ/mol,故D正确;
故选D.
点评 本题考查了热化学方程式书写方法和正误判断,掌握基础是关键,题目较简单.


科目:高中化学 来源: 题型:选择题
| A. | 甲乙互为同系物 | |
| B. | 甲乙互为同分异构体 | |
| C. | 等物质的量的甲、乙完全燃烧所耗O2的物质的量相等 | |
| D. | 甲、乙分别充分燃烧,产生CO2和H2O的物质的量之比均为1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 食用油不宜长时间高温反复使用 | |
| B. | 汽车尾气中的NO是氮气和氧气在高温下反应产生的 | |
| C. | 门窗玻璃和玛瑙手镯所用材料的主要成分都是硅酸盐 | |
| D. | 不锈钢在空气中非常稳定,是因为不锈钢表面形成了一层很薄的含铬氧化物致密膜,有效地保护内层金属 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
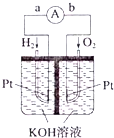 Ⅰ.甲硅烷(SiH4)常温下是一种无色气体,遇空气发生自燃.
Ⅰ.甲硅烷(SiH4)常温下是一种无色气体,遇空气发生自燃.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
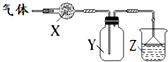 如图装置用于气体的干燥、收集和尾气吸收,其中X、Y、Z对应都正确的是( )
如图装置用于气体的干燥、收集和尾气吸收,其中X、Y、Z对应都正确的是( )| X | Y | Z | |
| A | 无水硫酸铜 | 氯气 | 饱和食盐水 |
| B | 碱石灰 | 氨气 | 水 |
| C | 氯化钙 | 二氧化硫 | 氢氧化钠 |
| D | 氯化钙 | 一氧化氮 | 氢氧化钠 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子序数:X>Y>Z>W | |
| B. | Y的气态氢化物的热稳定性比W的强 | |
| C. | 原子半径的大小顺序:r(Z)>r(Y)>r(W)>r(X) | |
| D. | X分别与Y、Z形成的化合物中化学键类型相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 编号 | ① | ② | ③ | ④ |
| pH | 10 | 10 | 4 | 4 |
| 溶液 | 氨水 | 氢氧化钠溶液 | 醋酸溶液 | 盐酸 |
| A. | 相同体积③、④溶液分别与NaOH完全反应,消耗NaOH物质的量:③>④ | |
| B. | 分别加水稀释10倍,四种溶液的pH①>②>④>③ | |
| C. | ①、④两溶液等体积混合,所得溶液中c(Cl-)>c(NH4+)>c(OH-)>c(H+) | |
| D. | Va L ④溶液与Vb L ②溶液混合(近似认为混合溶液体积=Va+Vb),若混合后溶液pH=5,则Va :Vb=11:9 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com